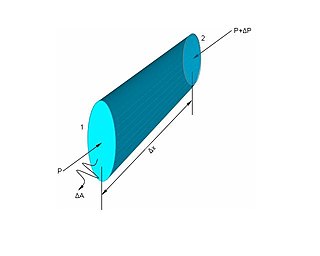
Basınç, bir yüzey üzerine etkide bulunan dik kuvvetin, birim alana düşen miktarı. Katı, sıvı ve gazlar ağırlıkları nedeniyle bulundukları yüzeye bir kuvvet uygularlar. Kuvvetin kaynağı ne olursa olsun birim yüzeye dik olarak etki eden kuvvete basınç (P), bütün yüzeye dik olarak etki eden kuvvete de basınç kuvveti (F) denir.
Olasılık kuramı ve istatistik bilim dallarında varyans bir rassal değişken, bir olasılık dağılımı veya örneklem için istatistiksel yayılımın, mümkün bütün değerlerin beklenen değer veya ortalamadan uzaklıklarının karelerinin ortalaması şeklinde bulunan bir ölçüdür. Ortalama bir dağılımın merkezsel konum noktasını bulmaya çalışırken, varyans değerlerin ne ölçekte veya ne derecede yaygın olduklarını tanımlamayı hedef alır. Varyans için ölçülme birimi orijinal değişkenin biriminin karesidir. Varyansın karekökü standart sapma olarak adlandırılır; bunun ölçme birimi orijinal değişkenle aynı birimde olur ve bu nedenle daha kolayca yorumlanabilir.
Derişim, bir çözeltideki çözünmüş madde miktarını incelemek için kullanılan bir kimya terimidir.

İdeal gaz yasası, sadece teoride olan ideal gazların durumları hakkında denklemler sağlayan bir yasadır. Bir miktar gazın durumu; basıncı, hacmi ve sıcaklığına göre belli olur. Bu denklem aşağıdaki gibidir:

- P paskal olarak basınç,
- V kübik metre olarak hacim,
- n gazın mol sayısı,
- R gaz sabiti
- T Kelvin olarak sıcaklık

Genleşme, sıcaklığı artırılan bir cismin uzunluk ya da hacminin değişmesi olayıdır.

Gaz yasaları, gazlardaki termodinamik sıcaklık (T), basınç (P) ve hacim (V) aralarındaki ilişkileri açıklayan bir takım kanundur. Rönesans'ın geç dönemleriyle 19. yüzyıl arasındaki dönemde bulunmuş birkaç yasadan oluşur.
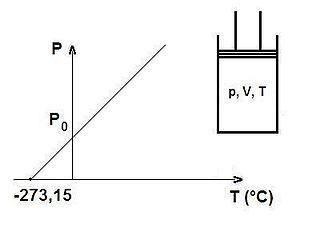
Gay-Lussac yasası, Fransız kimyacı Joseph Louis Gay-Lussac'ın adıyla anılır. Gay-Lussac'a mal edilen, iki tane gaz yasası vardır. İkisi de aynı isimle anılırlar. En ünlü deneyi gazlarla yaptığı sıcaklık değişiminin inciler üzerindeki basınç değişimini dedesi Mark Lussac ile yapmıştır.
Kinetik teori veya gazların kinetik teorisi, gazların basınç, sıcaklık, hacim gibi makroskobik özelliklerini moleküler bileşim ve hareketlerine bağlı olarak açıklayan teoridir. Esas olarak, teori Isaac Newton'un kanısının tersine basıncın moleküller arası statik itmeden kaynaklanmadığını, bunun yerine belli hızlarda hareket eden moleküller arası çarpışmalardan kaynaklandığını söyler. Kinetik teori aynı zamanda kinetik-moleküler teori veya çarpışma teorisi olarak da bilinir.

Enerji biçimleri, iki ana grubu ayrılabilir: kinetik enerji ve potansiyel enerji. Diğer enerji türleri bu iki enerji türünün karışımdan elde edilir.

Dalton yasası, bir gaz karışımının toplam basıncının, karışımı oluşturan gazların kısmi basınçlarının toplamına eşit olduğunu açıklayan bir fiziksel kimya yasasıdır. Bu ampirik yasa John Dalton tarafından 1801 yılında deneysel olarak gözlemlenmiş ve 1802 yılında yayımlanmıştır. Dalton yasası ideal gaz kanunlarıyla ilgilidir.
Dejenere elektron basıncı, kuantum elektron basıncı olgusundan daha genel olan bir basınçtır. Pauli dışlama ilkesi, bir atomda iki fermiyonun aynı anda tamamen aynı kuantum sayılarına sahip olmasına izin vermemektedir. Sonuçta aniden ortaya çıkan basınç, maddenin daha küçük hacimlerde sıkıştırılmasına karşı koyar. Dejenere elektron basıncı, saf bir maddenin elektron yörünge yapısı olarak tanımlanan, aynı temel mekanizmadan kaynaklanmaktadır. Freeman Dyson, katı maddelerin geçirmezliğinin önceden kabul edilmiş olan elektrostatik iteleme yerine, dejenere kuantum basıncından kaynaklandığını göstermiştir. Ayrıca, dejenere elektron basıncı yıldızların nükleer füzyonu dindiğinde kendi ağırlığı altında çökmesini engellemektedir. Yeterli büyüklükteki yıldızların çöküşünü engellemek için dejenere elektron basıncı yetersiz kalmaktadır ve nötron yıldızı oluşmaktadır. Bu durumda ise, dejenere nötron basıncı yıldızların daha fazla çökmesini engeller.

Joule genişlemesi termodinamikte (ısıdevinimsel) geri dönülmez (tersinemez) bir süreçtir. Burada ısısal olarak yalıtılmış bölmeli kabın bir tarafına belli bir hacimde gaz konur, kalan diğer tarafı ise boşaltılmıştır. Kabın ortasındaki engel kaldırılır ve bir taraftaki gaz tüm kaba yayılır.

Planck yasası belirli bir sıcaklıkta termal denge durumunda bulunan bir kara cisim ışımasının yaydığı elektromanyetik radyasyonu ifade eder. Yasa 1900 yılında Max Planck bu ismi önerdikten sonra isimlendirilmiştir. Planck yasası modern fiziğin ve kuantum teorisinin öncül bir sonucudur.
Fizikte, foton gazı, fotonların gaz benzeri birikmesidir ki hidrojen ve neon gibi sıradan gazlarla basınç, sıcaklık, entropi gibi benzer özelliklere sahiptir. Foton gazının dengedeki en yaygın örneği siyah cisim ışımasıdır.

Maxwell ilişkileri İkinci dereceden türevlerin simetri ve termodinamik potansiyellerin tanımlarından türetilebilen termodinamik denklemler dizisidir. Bu ilişkiler 19.yüzyıl fizikçisi James Clerk Maxwell tarafından adlandırılmıştır.
Darcy yasası  , bir sıvının gözenekli bir ortamdan akışını tanımlayan bir denklemdir. Yasa, yer bilimlerinin bir kolu olan hidrojeolojinin temeldir. Kum yataklarından su akışı ile ilgili deneylerin sonucu.
, bir sıvının gözenekli bir ortamdan akışını tanımlayan bir denklemdir. Yasa, yer bilimlerinin bir kolu olan hidrojeolojinin temeldir. Kum yataklarından su akışı ile ilgili deneylerin sonucu.
Kimya ve biyokimyada ayrışma, moleküllerin (veya tuzlar veya bileşikler gibi iyonik bileşiklerin) atomlar, iyonlar veya radikaller gibi daha küçük parçacıklara ayrıldığı genel bir süreçtir. Örneğin, bir asit suda çözündüğünde, bir elektronegatif atom ile bir hidrojen atomu arasındaki kovalent bir bağ, bir proton (H+) ve bir negatif iyon veren heterolitik fisyon tarafından kırılır. Ayrışma, birleşme veya rekombinasyonun tersidir.
Termodinamikte izovolümetrik süreç veya izometrik süreç olarak da adlandırılan izokorik süreç kapalı sistem hacminin sabit kalması demektir. İzokorik bir süreç, kapalı, elastik olmayan bir kabın içeriğinin ısıtılması veya soğutulması ile örneklendirilebilir. Kapalı sistem kabın içeriğinin dışarıya karşı izole olmasıdır. Kap deforme olmaz ve hacmi termodinamik süreç boyunca sabit kalırsa bu bir izokorik süreç örneğidir.
Kavitasyon sayısı olarak adlandırılabilecek üç boyutsuz sayı mevcuttur: hidrodinamik kavitasyon durumları için kavitasyon sayısı, pompalarda kavitasyon için Thoma sayısı ve ultrasonik kavitasyon için Garcia-Atance sayısı.
























