Kimya, maddenin yapısını, özelliklerini, birleşimlerini, etkileşimlerini, tepkimelerini araştıran ve uygulayan bilim dalıdır. Kimya bilmi daha kapsamlı bir ifadeyle maddelerin özellikleriyle, sınıflandırılmasıyla, atomlarla, atom teorisiyle, kimyasal bileşiklerle, kimyasal tepkimelerle, maddenin hâlleriyle, moleküller arası ve moleküler kuvvetlerle, kimyasal bağlarla, tepkime kinetiğiyle, kimyasal dengenin prensipleriyle vb konularla ilgilenir. Kimyanın en önemli dalları arasında analitik kimya, anorganik kimya, organik kimya, fizikokimya ve biyokimya sayılır.
Pauli dışarlama ilkesi ya da Pauli dışlama ilkesi, iki ya da daha çok özdeş fermiyonun aynı kuantum durumda olamayacağını belirten bir kuantum mekaniği yasasıdır. Bu yasa, kuramsal fizikçi Wolfgang Pauli tarafından 1925 yılında bulunmuştur. İlk bulunuşunda yasa yalnızca elektronlar için geçerliyken, 1940 yılında Spin-istatistik teoreminin bulunmasıyla birlikte bütün fermiyonları kapsayacak biçimde genişletilmiştir.

Alkenler yapılarında en az bir tane karbon-karbon (C=C) çift bağı içeren organik bileşiklerdir. Alkenlerin yapısında karbon-karbon çift bağı bulunduğundan ve bu karbonların yapabileceği en fazla hidrojenle bağ yapmamış olduğundan alkenler doymamış bileşikler kategorisine girerler. Alkenlerin yapısında sadece bir karbon-karbon çift bağının bulunması durumunda homolog seriler oluşturur. Bu homolog serilerin genel formülü CnH2n şeklindedir. Burada n-in en az 2 olma şartı vardır. Aşağıda en basit alken olan eten, yaygın ismiyle etilenin, çeşitli modellemelerle çizilmiş şekillerinin yanı sıra alkenlerin çeşitli şekillerdeki yazılış şekilleri de bulunmaktadır.

Kovalent bağ, atomlar arasında elektron çiftleri oluşturmak için elektronların paylaşımını içeren kimyasal bağdır. Bu elektron çiftlerine paylaşılan çiftler veya bağ çiftleri denir. Atomlar arasında elektronları paylaştıklarında çekici ve itici kuvvetlerin kararlı dengesine kovalent bağ denir. Birçok molekül için elektronların paylaşılması her atomun kararlı elektronik gruplaşmasına denk gelen tam değerlik kabuğunun eşdeğerine ulaşmasına olanak tanır.

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.

Atom çekirdeği, atomun merkezinde yer alan, proton ve nötronlardan oluşan küçük ve yoğun bir bölgedir. Atom çekirdeği 1911 yılında Ernest Rutherford tarafından keşfedildi. Bu keşif, 1909 yılında gerçekleştirilen Geiger-Marsden deneyine dayanmaktadır. Nötronun James Chadwick aracılığıyla 1932 yılında keşfinden sonra, çekirdeğin proton ve nötronlardan oluştuğu modeli Dmitri Ivanenko ve Werner Heisenberg tarafından çabucak geliştirildi. Atomun kütlesinin neredeyse tamamı çekirdek içerisindedir, elektron bulutunun atom kütlesine katkısı oldukça azdır. Proton ve nötronlar çekirdek kuvveti tarafından çekirdeği oluşturmak için birbirlerine bağlanmıştır.

Enerji seviyesi, atom çekirdeğinin etrafında katman katman biçiminde bulunan kısımların her biridir. Bu yörüngelerde elektronlar bulunur. Yörüngenin numarası; 1, 2, 3, 4, ... gibi sayı değerlerini alabilir. Yörünge numarasına baş kuantum sayısı da denir ve "n" ile gösterilir. Yörünge numarası ile yörüngenin çekirdeğe uzaklığı doğru orantılıdır.
Koordine kovalent bağ, ametal-ligand arasındaki bağın, sadece ligand üzerindeki elektronlar ile oluşması durumunda oluşan kovalent bağ türü. Elektron ortaklaşması göstermemektedir.

Organik kimyada bazı atom halkalarının yapısı beklenenin üstünde kararlıdır. Doymamış bağlar, yalın elektron çiftleri veya boş orbitallerden oluşan konjüge bir halkanın konjüge olmasından beklenecek kararlılıktan daha yüksek bir kararlılık gösterme özelliğine aromatiklik denir. Aromatiklik, halkasal delokalizasyon ve rezonansın bir belirtisi olarak da düşünülebilir.

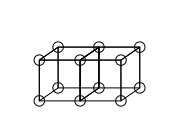
Geometride tetrahedron veya dört yüzlü, dört üçgen yüzden oluşan bir çokyüzlüdür (polihedron), her köşesinde üç üçgen birleşir. Düzgün dört yüzlü dört üçgenin eşkenar olduğu bir dört yüzlüdür ve Platonik cisimlerden biridir. Dörtyüzlü, dört yüzü olan tek konveks çokyüzlüdür. Tetrahedron isminin sıfat hali "tetrahedral"dır.
Değerlik kabuğu elektron çifti itmesi kuralları moleküllerin şekillerini tahmin etmede kullanılır ve değerlik elektron çiftlerinin birbirlerini elektrostatik kuvvetle itmesi temeline dayanır. Teorinin yaratıcısı olan bilim adamlarına atfen Gillespie–Nyholm teorisi olarak da adlandırılır. "VSEPR" kısaltması kimi zaman "vespır" olarak da telaffuz edilebilir.
Teoriye göre atomları çevreleyen değerlik elektron çiftleri birbirlerini iterek aralarındaki itme kuvvetini en aza indirirler ve böylece moleküle şeklini verirler. Merkez atoma bağlı atomların sayısı ile bağ yapmamış elektron çiftlerinin sayısının toplamı sterik numarayı verir.
Moleküller arası kuvvet, komşu parçacıklar arasında etkili çekim veya itme kuvvetidir. Molekülleri bir arada tutan iç kuvvetlere kıyasla daha zayıftır. Örneğin HCI moleküllerinin içinde bulunan kovalent bağ, birbirine yeterince yakın komşu moleküller arasında mevcut olan kuvvetlerden daha güçlüdür.

X ışını kristalografisi bir kristalin atomik ve moleküler yapısını incelemek için kullanılan ve kristalleşmiş atomların bir X-ışını demetindeki ışınların kristale özel çeşitli yönlerde kırınımı olayına dayanan, bir yöntemdir. Kırınıma uğrayan bu demetlerin açılarını ve genliklerini ölçerek bir kristalografi uzmanı kristaldeki elektronların yoğunluğunun üç boyutlu bir görüntüsünü elde edebilir. Bu elektron yoğunluğundan kristaldeki atomların kimyasal bağları, kristal yapıdaki düzensizlikler ve bazı başka bilgilerle birlikte ortalama konumları tespit edilebilir.

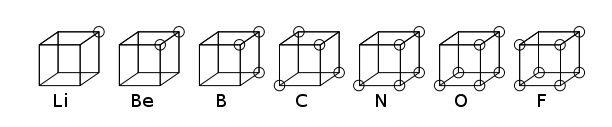
Periyodik tablo, kimyasal elementlerin atom numarası, elektron konfigürasyonu ve yinelenen kimyasal özelliklerini baz alarak hazırlanmış bir düzenlemedir. Elementler artan atom numarasına göre sıralanmıştır. Tablonun standart formunda sistematik bir şekilde gösterilen elementlerle birlikte periyot adı verilen sıralar ve grup olarak adlandırılmış sütunlar bulunmaktadır.
Lewis asiti Lewis bazıyla Lewis eklenme ürününü oluşturmak için etkileşen kimyasal türdür. Lewis bazı, Lewis eklenme ürününü oluşturmak için, Lewis asidine elektron çifti veren türdür. Örneğin, OH− ve NH3 Lewis bazlarıdır çünkü bu iyonlar bağ yapmamamış elektron çiftlerini verebilirler. Eklenme ürününde, Lewis asidi ve bazı Lewis bazından gelen elektron çiftini paylaşır. Lewis asit ve bazının isim babası Gilbert N. Lewis'dir.

Yöresizleşmiş elektronlar veya delokalize elektronlar bir katı metal, iyon veya molekülde bulunan elektronların tek bir atom veya kovalent bağ ile ilişkili olmamasını tanımlar.

Kimyada, doğrusal moleküler geometri 180°'lik bir açıya yerleştirilmiş diğer iki atoma bağlanmış merkezi bir atom etrafındaki geometriyi tarif eder. Asetilen (HC≡CH) gibi doğrusal organik moleküller genellikle karbon merkezleri için sp orbital hibridizasyonu teşvik edilerek tarif edilir.
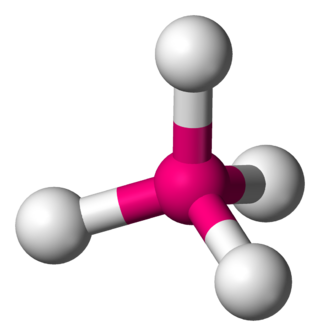
Dörtyüzlü veya tetrahedral molekül geometrisi, merkezi atomun, dört yüzlünün ortasında, dört köşede ise sübstitüentlerin yer aldığı molekül geometrisidir. Bağ açıları, dört sübstitüent aynı olduğunda (örn. metan CH4 ya da daha ağır analogları) cos−1 (-⅓) = 109,4712206 ...° ≈ 109.5° olur. Metan veya diğer simetrik yüzlü moleküller Td nokta grubuna aittir, ama dörtyüzlü moleküller genellikle düşük simetriye sahiptir. Tetrahedral moleküller kiral olabilir.

Langmuir adsorpsiyon modeli, bir adsorbatın izotermal koşullarda ideal bir gaz olarak davrandığını varsayarak adsorpsiyonu açıklar. Modele göre adsorpsiyon ve desorpsiyon tersinir işlemlerdir. Bu model, bu koşullar altında katı biradsorban üzerine absorbe edilen hacmine, V, bağlı olan kısmi adsorbatın kısmi basıncını,  bile açıklar. Şekilde gösterildiği gibi, adsorbanın, adsorbatları bağlayabilen bir dizi farklı bölgeden oluşan ideal bir katı yüzey olduğu varsayılır. Adsorbat bağlanması, adsorbat gazlı molekül
bile açıklar. Şekilde gösterildiği gibi, adsorbanın, adsorbatları bağlayabilen bir dizi farklı bölgeden oluşan ideal bir katı yüzey olduğu varsayılır. Adsorbat bağlanması, adsorbat gazlı molekül  ve boş bir sorpsiyon sahası, S arasında bir kimyasal reaksiyon olarak işlenir. Bu reaksiyon, ilişkili bir denge sabiti ile
ve boş bir sorpsiyon sahası, S arasında bir kimyasal reaksiyon olarak işlenir. Bu reaksiyon, ilişkili bir denge sabiti ile  ile adsorbe edilmiş bir tür
ile adsorbe edilmiş bir tür  ile sonuçlanır.
ile sonuçlanır.

Karbon-karbon bağı, iki karbon atomu arasındaki kovalent bir bağdır. En yaygın şekli tekli bağdır: iki atomun her birinden birer tane olmak üzere iki elektrondan oluşan bir bağ. Karbon-karbon tekli bağı bir sigma bağıdır ve karbon atomlarının her birinden bir hibridize orbital arasında oluşur. Etanda orbitaller sp3-hibridize orbitallerdir, ancak diğer hibridizasyonlara sahip karbon atomları arasında oluşan tek bağlar meydana gelir. Aslında, tekli bağdaki karbon atomlarının aynı hibridizasyona sahip olması gerekmez. Karbon atomları ayrıca alken adı verilen bileşiklerde çift bağ veya alkin adı verilen bileşiklerde üçlü bağ oluşturabilir. Bir çift bağ, sp2-hibritleşmiş bir orbital ve hibritleşmeye dahil olmayan bir p-orbitali ile oluşturulur. Üçlü bağ, sp-hibritleşmiş bir orbital ve her atomdan iki p-orbitali ile oluşturulur. P-orbitallerinin kullanımı bir pi bağı oluşturur.