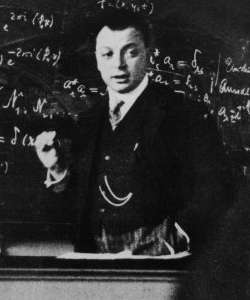Kimya, maddenin yapısını, özelliklerini, birleşimlerini, etkileşimlerini, tepkimelerini araştıran ve uygulayan bilim dalıdır. Kimya bilmi daha kapsamlı bir ifadeyle maddelerin özellikleriyle, sınıflandırılmasıyla, atomlarla, atom teorisiyle, kimyasal bileşiklerle, kimyasal tepkimelerle, maddenin hâlleriyle, moleküller arası ve moleküler kuvvetlerle, kimyasal bağlarla, tepkime kinetiğiyle, kimyasal dengenin prensipleriyle vb konularla ilgilenir. Kimyanın en önemli dalları arasında analitik kimya, anorganik kimya, organik kimya, fizikokimya ve biyokimya sayılır.

Atom veya ögecik, bilinen evrendeki tüm maddenin kimyasal ve fiziksel niteliklerini taşıyan en küçük yapı taşıdır. Atom Yunancada "bölünemez" anlamına gelen "atomos"tan türemiştir. Atomus sözcüğünü ortaya atan ilk kişi MÖ 440'lı yıllarda yaşamış Demokritos'tur. Gözle görülmesi imkânsız, çok küçük bir parçacıktır ve sadece taramalı tünelleme mikroskobu vb. ile incelenebilir. Bir atomda, çekirdeği saran negatif yüklü bir elektron bulutu vardır. Çekirdek ise pozitif yüklü protonlar ve yüksüz nötronlardan oluşur. Atomdaki proton sayısı elektron sayısına eşit olduğunda atom elektriksel olarak yüksüzdür. Elektron ve proton sayıları eşit değilse bu parçacık iyon olarak adlandırılır. İyonlar oldukça kararsız yapılardır ve yüksek enerjilerinden kurtulmak için ortamdaki başka iyon ve atomlarla etkileşime girerler.

Karbon, doğada yaygın bulunan ametal kimyasal elementtir. Evrende bolluk bakımından altıncı sırada yer alan karbon, kızgın yıldızlarda hidrojenin termonükleer yanmasında temel rol oynar. Dünyada hem doğal halde, hem de başka elementlerle bileşik halinde bulunan karbon, ağırlık olarak Dünya'nın yerkabuğunun yaklaşık %0,2'sini oluşturur. En arı (katışıksız) biçimleri elmas ve grafittir; daha düşük arılık derecelerinde maden kömürünün, kok kömürünün ve odun kömürünün bileşeni olarak bulunur. Atmosferin yaklaşık % 0,05'ini oluşturan ve bütün doğal sularda erimiş olarak bulunan karbon dioksit, kireç taşı ve mermer gibi karbonat mineralleri, kömürün, petrolün ve doğalgazın başlıca yapıtaşları olan hidrokarbonlar, en bol bulunan bileşikleridir.
Atom ağırlığı ya da bağıl atom kütlesi, belirli bir örnekteki bir elementin atomlarının ortalama kütlesinin atomik kütle sabitine oranı olarak tanımlanan boyutsuz bir fiziksel niceliktir. Atomik kütle sabiti, bir karbon-12 atomunun kütlesinin 1/12'si olarak tanımlanır. Orandaki her iki miktar da kütle olduğundan, ortaya çıkan değer boyutsuzdur; dolayısıyla değerin göreceli (bağıl) olduğu ifade edilir.

Elektromanyetizma, elektrikle yüklü parçacıklar arasındaki etkileşime neden olan fiziksel kuvvet'tir. Bu etkileşimin gerçekleştiği alanlar, elektromanyetik alan olarak tanımlanır. Doğadaki dört temel kuvvetten biri, elektromanyetizmadır. Diğer üçü; güçlü etkileşim, zayıf etkileşim ve kütleçekim kuvvetidir.
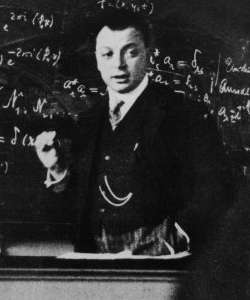
Pauli dışarlama ilkesi ya da Pauli dışlama ilkesi, iki ya da daha çok özdeş fermiyonun aynı kuantum durumda olamayacağını belirten bir kuantum mekaniği yasasıdır. Bu yasa, kuramsal fizikçi Wolfgang Pauli tarafından 1925 yılında bulunmuştur. İlk bulunuşunda yasa yalnızca elektronlar için geçerliyken, 1940 yılında Spin-istatistik teoreminin bulunmasıyla birlikte bütün fermiyonları kapsayacak biçimde genişletilmiştir.

Katı, maddenin atomları arasındaki boşluğun en az olduğu halidir. "Katı" olarak adlandırılan bu haldeki maddelerin kütlesi, hacmi ve şekli belirlidir. Bir dış etkiye maruz kalmadıkça değişmez. Sıvıların aksine katılar akışkan değildir. Fiziksel yollarla, diğer üç hal olan sıvı, gaz ve plazmaya dönüştürülebilirler. Altın demir gibi madenler katı maddelere örnektir. Ayrıca katı maddeler atomlarının en yavaş hareket edebildiği haldir. Doğa'da amorf veya kristal yapıda bulunurlar. Amorf katılar maddenin taneciklerinin düzensiz olma durumudur. Kristal katılar ise de maddenin taneciklerinin düzenli olma durumudur. Kristal katılar da aralarında 4'e ayrılır.

Mira Ceti, (diğer adları: Mira, Omicron Ceti, Omicron Balina, Balinanın Harika Yıldızı, The Wonderful) Balina takımyıldızı yönünde bulunan "Mira" olarak adlandırılan değişen yıldız sınıfına ismini veren ve Dünya'ya 418,2 ışık yılı uzaklıkta bulunan kırmızı dev yıldızdır.

Molekül, birbirine bağlı gruplar halindeki atomların oluşturduğu kimyasal bileşiklerin en küçük temel yapısına verilen addır. Diğer bir ifadeyle bir molekül bir bileşiği oluşturan atomların eşit oranlarda bulunduğu en küçük birimdir. Moleküller yapılarında birden fazla atom içerirler. Bir molekül aynı iki atomun bağlanması sonucu ya da farklı sayılarda farklı atomların bağlanması sonucunda oluşabilirler. Bir su molekülü 3 atomdan oluşur; iki hidrojen ve bir oksijen. Bir hidrojen peroksit molekülü iki hidrojen ve 2 oksijen atomundan oluşur. Diğer taraftan bir kan proteini olan gamma globulin 1996 sayıda atomdan oluşmakla birlikte sadece 4 çeşit farklı atom içerir; hidrojen, karbon, oksijen ve nitrojen. Molekülleri oluşturan kimyasal bağlara Moleküler bağlar denir. Bunlar kovalent, iyonik ve metalik bağlardır.

Cetus ya da Balina takımyıldızı, modern 88 takımyıldızdan biridir. Kuzey gökkürededir. Cetus adı, her ne kadar günümüzde sıklıkla balina dense de, Yunan mitolojisi'ndeki bir deniz canavarı olan Cetus´tan gelmektedir. Balina, Kova, Balık ve Irmak takımyıldızları gibi diğer suyla ilgili tasvir edilen takımyıldızlarla birlikte, Su olarak bilinen gökyüzü bölgesindedir.

İyon ya da yerdeş, bir veya daha çok elektron kazanmış ya da yitirmiş bir atomdan oluşmuş elektrik yüklü parçacıktır. Atomlar kararsız yapılarından kurtulmak ve kararlı hale gelebilmek için elektron alırlar ya da kaybederler. Bunun için de başka bir atomla ya da kökle bağ kurarlar.

Kimya'da, hidrojen bağı öncelikle daha elektronegatif bir "verici" atom veya gruba (Dn) kovalent bağla bağlanan bir hidrojen (H) atomu ile ve yalnız bir çift elektron taşıyan başka bir elektronegatif atom arasındaki elektrostatik çekim kuvvetidir.

Kovalent bağ, atomlar arasında elektron çiftleri oluşturmak için elektronların paylaşımını içeren kimyasal bağdır. Bu elektron çiftlerine paylaşılan çiftler veya bağ çiftleri denir. Atomlar arasında elektronları paylaştıklarında çekici ve itici kuvvetlerin kararlı dengesine kovalent bağ denir. Birçok molekül için elektronların paylaşılması her atomun kararlı elektronik gruplaşmasına denk gelen tam değerlik kabuğunun eşdeğerine ulaşmasına olanak tanır.

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.

Manyeto optik tuzak, soğuk, kapana kısılmış nötr örnekleri üretebilmek için lazer soğutma ve uzamsal olarak değişen bir manyetik alan kullanan bir cihazdır. Bir MOT'tan elde edilen sıcaklıklar, foton geri tepme sınırının iki veya üç katı olan atomik türe bağlı olarak birkaç mikrokelvin kadar düşük olabilir. Bununla birlikte, çözülmemiş aşırı ince yapıya sahip atomlar için, örneğin;bir MOT'nta elde edilen sıcaklık Doppler soğutimitinden den daha yüksek olacaktır.

Değişen yıldız, parlaklıkları zaman içinde değişen yıldızlardır. Parlaklıkları genelde ya çok gençken ya da çok yaşlı iken değişir. Bunun nedeni, ya genişleme, daralma, püskürme gibi yıldızın iç dinamiğinden; ya da iki ya da daha fazla yıldızın birbirlerinin yörüngelerinde dönerken oluşturdukları tutulmalardan kaynaklanan dış dinamiklerden dolayı oluşur. 2000 yılına kadar 30,000'in üzerinde değişken yıldız bulunup kataloglanmıştır. Ayrıca 14,000 kadar başka yıldızda parlaklık değişiminden şüphelenilmektedir. Güneşimiz ve Kutup Yıldızı dahil olmak üzere birçok yıldızın, yeterli duyarlılıkta ölçüldüğünde, parlaklıkları değişmektedir.
Rydberg sabiti, Rydberg formülündeki sabittir ve uyarılmış hidrojen atomunun yaydığı elektromanyetik ışınımın dalgaboyunun hesaplanmasında kullanılır. Bu sabit adını İsveçli fizikçi Johannes Rydberg'ten (1854-1919) almıştır. Sabitin sayısal değeri fizikte kullanılan diğer sabitlerden türetilmiştir.
S Orionis, Avcı takımyıldızı yönünde yaklaşık olarak 702 ışık yılı uzaklıkta bulunan M-tipi kırmızı dev yıldızdır. S Ori, Mira tipi bir değişen yıldızdır ve görünür parlaklığı 414 günlük bir süre içerisinde; 7,2 kadir ile 14,0 kadir aralığında değişkenlik göstermektedir.

U Orionis, Avcı takımyıldızı yönünde yaklaşık olarak 998 ışık yılı uzaklıkta bulunan ve 120 yılı aşkın bir süredir gözlemlenen, klasik bir uzun dönemli Mira-tipi değişen yıldızdır. 13 Aralık 1885 tarihinde J.E. Gore tarafından keşfedilmiştir. Başlangıçta bir nova olduğu düşünülüyordu ama Harvard'da alınan bir tayf örneği Mira benzeri özelliklerini göstermiştir. Böylece U Orionis, tayf fotoğrafıyla tespit edilen ilk uzun dönemli değişen yıldız olmuştur.
Kimya felsefesi, kimya biliminin temelindeki varsayımları ve metodolojiyi inceler. Kimya felsefesi, filozoflar, kimyagerler ve filozof kimyacılar tarafından araştırılmıştır. Tarihin büyük bölümünde bilim felsefesi büyük oranda fizik felsefesinden oluşmaktaydı fakat kimya kaynaklı felsefi sorular 20. yüzyılın ikinci yarısından itibaren artan düzeyde ilgi görmüştür.