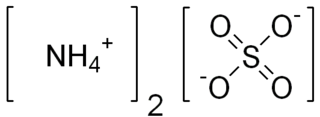Hidroliz işlemi suyu oluşturan hidrojen ve oksijen elementlerinin birbirinden ayrılması ile sonuçlanan bir işlemdir. Bazı kaynaklarda hidroliz, moleküllerin su ilavesiyle daha fazla sayıda parçacık oluşturması olarak da geçer. Hidroliz, su ile bir kimyasal bağın parçalanmasıdır yani bir kimyasal reaksiyondur. Hidroliz genel olarak suyun nükleofil olduğu ikame(yer değiştirme reaksiyonu), eliminasyon(organik reaksiyon türü) ve solvasyon (çözme) reaksiyonları için kullanılır.

Üre (Latince Urea Pura), organik bir bileşik. Formülü H2N-CO-NH2'dir. Karbonik asidin diamidi olan üre aynı zamanda karbamik asidin de amidi olduğundan karbamid adı ile de bilinir.

Sodyum karbonat, (çamaşır sodası, kristal soda ve soda külü olarak da bilinir) Na2CO3 formülüne sahip değişik hidratları olan bir inorganik bileşiktir. Bütün formları beyaz, suda çözünür tuzlardır. Tüm formları güçlü bir alkali tada sahiptir ve suda orta derecede alkali çözeltiler verir. Tarihsel olarak sodyum bakımından zengin göl sularından veya sodyum bakımından zengin topraklarda yetişen bitkilerin küllerinden çıkarıldı. Bu sodyum açısından zengin bitkilerin külleri, potas üretmek için kullanılan odun küllerinden belirgin şekilde farklı olduğundan, "soda külü" olarak anıldı. Günümüzde ise, Solvay işlemi ile sodyum klorür ve kireç taşından büyük miktarlarda üretilmektedir.

Aminler, amonyaktaki bir veya daha fazla hidrojen atomunun organik radikaller ile değiştirilmesi yöntemiyle türetilmiş organik bileşikler ve fonksiyonel gruplardır. Yapısal olarak aminler amonyağa benzerler, ama bir veya daha fazla hidrojen atomu, alkil veya aril gibi organik sübstitüentlerle yer değiştirmiştir. Bu kuralın önemli bir istisnası RC(O)NR2 tipi bileşiklerdir (C(O) karbonil grubuna karşılık gelir), bunlara amin yerine amid denir. Amidler ve aminlerin yapıları ve özellikleri farklı olduğu için bu ayrım kimyasal olarak önemlidir. Adlandırma açısında biraz akıl karıştırıcı olan bir nokta, bir aminin N-H grubunun N-M (M= metal) ile değişmesi hâlinde buna da amid denmesidir. Örneğin (CH3)2NLi, lityum dimetilamid'dir.
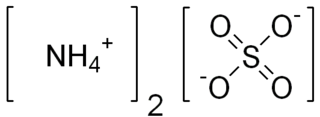
Amonyum sülfat, (NH4)2SO4 formülüne ve çok sayıda ticari kullanıma sahip bir inorganik tuzdur. Toprak gübresi olarak yaygın bir şekilde kullanılır. %21 azot ve %24 kükürt içerir.
Adolph Strecker tarafından bulunan Strecker amino asit sentezi bir aldehit dan bir dizi kimyasal reaksiyonla bir amino asit sentezlenmesidir. Aldehit potasyum siyanür eşliğinde amonyum klorür ile bir α-aminonitril oluşturacak şekilde reaksiyona sokulur. Daha sonra bu α-aminonitril hidrolize edilerek istenilen amino asit elde edilir. Orijinal Strecker reaksiyonunda asetaldehit, amonyak ve hidrojen siyanür ün verdiği reaksiyon ürünü, hidrolizlenerek alanin elde edilmiştir.

Amonyum klorür ya da daha çok bilinen adıyla Nişadır, formülü NH4Cl olan bir kimyasal bileşiktir. Suda yüksek oranda çözünen, beyaz kristallere sahip bir tuzdur. Amonyum klorür çözeltileri hafif asidiktir. Doğada mineral halde bazı volkan bacalarının etrafında bulunan haline sal amonyak denir. Bazı tür meyan ballarında bir aroma maddesi olarak kullanılır. Nişadır, hidroklorik asit ve amonyak arasında gerçekleşen reaksiyonla sonucu oluşur.

İyot monoklorür ICl formülü ile gösterilen bir interhalojen bileşiktir. Oda sıcaklığına yakın eriyen kırmızı-kahverengi renge sahip bir kimyasal bileşiktir. İyot ve klorun elektronegatifliği arasındaki fark nedeniyle, ICl oldukça kutupsaldır ve I+ kaynağı olarak davranır.
Siyanojen iyodür veya iyot siyanür (ICN), iyot ve siyanür grubundan oluşan bir psödohalojendir. Nispeten uçucu ve oldukça toksik bir inorganik bileşiktir. Hidrojen siyanür oluşturmak üzere suyla yavaşça reaksiyona giren beyaz kristaller halinde ortaya çıkar.

Hidrojen iyodür (HI) iki atomlu bir molekül ve hidrojen halojenürdür. Sulu çözeltisi, güçlü bir asit olan hidroiyodik asit veya hidriyodik asit olarak bilinir. Bununla birlikte, hidrojen iyodür ve hidroiodik asit, birincisinin standart koşullar altında bir gaz olması, diğerinin ise söz konusu gazın sulu bir çözeltisi olması bakımından farklıdır. Birbirine dönüştürülebilir. HI, organik ve inorganik sentezlerde birincil iyot kaynaklarından biri ve bir indirgeyici madde olarak kullanılır.

Fülminik asit, HCNO moleküler formülünü içeren kimyasal bir bileşiktir. Gümüş tuzu, 1798'de, gümüş nitrik asit içinde eritildiyse ve şarabın ruhuna eklenen çözeltinin, beyaz, oldukça patlayıcı bir toz elde edildiğini tespit eden Luigi Valentino Brugnatelli tarafından keşfedildi. 1800'de Edward Charles Howard da gümüş tuzu üretti ve daha sonra 1824'te Justus von Liebig tarafından araştırıldı. Howard ayrıca, 1799'da, Brugnatelli'nin işleminde gümüş yerine gümüş cıvası olan cıva tuzunu yarattı. Organik bir asit ve gümüş tuzu 1825'te Friedrich Wöhler tarafından keşfedilen izosiyanik asit izomeridir. Serbest asit ilk olarak 1966'da izole edildi.

Kloroplatinik asit (hekzakloroplatinik asit olarak da bilinir), [H3O]2[PtCl6](H2O)x (0≤x≤6) formülüne sahip bir inorganik bileşiktir. Kırmızı bir katı, genellikle sulu bir çözelti olarak önemli bir platin kaynağıdır. Genellikle kısaca H2PtCl6 olarak yazılsa da, hekzakloroplatinat anyonunun (PtCl62-) hidronyum (H3O+) tuzudur. Hekzakloroplatinik asit oldukça higroskopiktir.

Magnezyum nitrat Mg(NO3)2(H2O)x formülüne sahip inorganik bileşikleri ifade eder. Formüldeki, x = 6, 2 ve 0 olabilir. Hepsi beyaz renkli katılardır. Susuz madde higroskopiktir, havada bekletildiğinde hızlı bir şekilde hekzahidrat oluşturur. Bütün tuzları hem suda hem de etanolde çok çözünür.

Kalsiyum nitrat, (Norveç güherçilesi) olarak da adlandırılır. Ca(NO3)2 formülüne sahip bir inorganik bileşiktir. Bu renksiz tuz havadan nem çeker ve genellikle bir tetrahidrat olarak bulunur. Esas olarak gübrelerde bileşen olarak kullanılırsa da başka uygulamalarda da kullanılır. Nitrokalsit, çiftlik gübresinin ahır veya mağaralarda olduğu gibi kuru bir ortamda beton veya kireç taşı ile temas ettiği yerlerde bir çiçeklenme olarak oluşan hidratlı bir kalsiyum nitrat olan bir mineralin adıdır. Kalsiyum amonyum nitrat dekahidrat ve kalsiyum potasyum nitrat dekahidrat dahil çeşitli ilgili tuzları bilinmektedir.

Nitro bileşikleri, bir veya daha fazla nitro fonksiyonel grubu (−NO2) içeren organik bileşiklerdir. Nitro grubu, dünya çapında kullanılan en yaygın eksplosoforlardan (bileşiği patlayıcı madde yapan fonksiyonel grup) biridir. Nitro grubuda güçlü bir elektron çeken gruptur. Bu özellik nedeniyle, nitro grubuna alfa (bitişik) olan C-H bağları asidik olabilir. Aynı nedenden dolayı, aromatik bileşiklerde nitro grubunun varlığı elektrofilik aromatik sübstitüsyonu yavaşlatsa da nükleofilik aromatik sübstitüsyonu kolaylaştırır. Nitro grupları, doğada nadiren bulunur ve nitrik asit ile başlayan nitrolama reaksiyonları tarafından neredeyse her zaman üretilir.
Organik kimyada, Diels-Alder tepkimesi, ikame edilmiş bir sikloheksen türevi oluşturmak için konjuge bir dien ile ikame edilmiş bir alken -genellikle dienofil olarak adlandırılır- arasında gerçekleşen kimyasal bir reaksiyondur. İlk kez 1928'de Otto Diels ve Kurt Alder tarafından tanımlandı. Bu kişiler bu reaksiyonun keşfi için 1950'de Nobel Kimya Ödülü'ne layık görüldüler. İki yeni karbon-karbon bağının eşzamanlı olarak inşası yoluyla, Diels–Alder reaksiyonu, bölgesel ve stereokimyasal sonuçlar üzerinde iyi bir kontrole sahip altı üyeli halkalar oluşturmak için güvenilir bir yol sağlar. Sonuç olarak, doğal ürünlerin ve yeni malzemelerin sentezinde kimyasal karmaşıklığın girişi için güçlü ve yaygın olarak uygulanan bir araç olarak hizmet etmiştir. Tipik olarak negatif ΔH° ve ΔS° değerlerine sahip olmalarından dolayı, bir Diels–Alder reaksiyonunun mikroskobik tersi, yüksek sıcaklıklarda elverişli hale gelir, ancak bu sadece sınırlı bir grup Diels-Alder eklenme ürünü için sentetik önem taşır. Bu ters reaksiyon, retro-Diels-Alder tepkimesi olarak bilinir.

Bir Grignard reaktifi veya Grignard bileşiği, X'in bir halojen ve R'nin normalde bir alkil veya aril olduğu organik bir grup olduğu genel formül R−Mg−X'e sahip kimyasal bir bileşiktir. İki tipik örnek, metilmagnezyum klorür Cl−Mg−CH
3 ve fenilmagnezyum bromür (C
6H
5)−Mg−Br'dir. Organomagnezyum bileşiklerinin bir alt sınıfıdır.

Hell-Volhard-Zelinski halojenasyon reaksiyonu, α karbonunda bir karboksilik asitin halojenasyonunu içeren kimyasal bir dönüşümdür. Bu reaksiyonun gerçekleşmesi için α karbonunun en az bir proton taşıması gerekir. Reaksiyon, Alman kimyagerler Carl Magnus von Hell (1849-1926) ve Jacob Volhard (1834-1910) ile Rus kimyager Nikolay Zelinski'nin (1861-1953) adını almıştır.


Amonyum fosfat, (NH4)3PO4 formülüne sahip inorganik bileşiktir. Ortofosforik asidin amonyum tuzudur. Benzer bir "çift tuz", (NH4)3PO4.(NH4)2HPO4 de tanınmaktadır. Ancak kullanımı pratik değildir. Her iki triamonyum tuzu da amonyak gazı yayar. Triamonyum tuzlarının kararsız doğasının aksine, diamonyum fosfat (NH4)2HPO4 ve monoamonyum tuzu (NH4)H2PO4 bitkilere sabit azot ve fosfor sağlamak için gübre olarak yaygın olarak kullanılan kararlı maddelerdir.

Reimer–Tiemann reaksiyonu, fenollerin orto-formilasyonu için kullanılan kimyasal bir reaksiyondur. Bu reaksiyon ilk olarak Karl Reimer ve Ferdinand Tiemann tarafından rapor edildi.