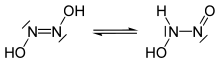Kral suyu, asitlerin az etki ettiği ya da etki etmediği altın ve platin gibi metallerle tepkimeye girebilen kuvvetli bir asit çözeltisidir. Hidroklorik asit ve nitrik asitin 3:1 oranında karıştırılmasıyla oluşur. Ebu Musa Câbir bin Hayyan tarafından bulunduğu tahmin edilmektedir.

Hidroklorik asit, hidrojen ve klor elementlerinden oluşan, oda sıcaklığı ve normal basınçta gaz hâlinde olan hidrojen klorürün sulu çözeltisine verilen ad. Halk arasında tuz ruhu olarak da bilinir. 9. yüzyılda simyacı Câbir bin Hayyân tarafından keşfedildi ve sonrasında simya alanında kullanıldı. Sanayi Devrimi sırasında, sanayideki önemi keşfedilen asit, önce Leblanc işlemi, sonrasında Solvay işlemi ile sanayi alanında üretilmeye başladı. Hidroklorik asit, tarihte yeni kolaylıkların keşfinde önemli roller üstlendi. Günümüzde PVC'den demir-çeliğe, organik madde üretiminden gıda sektörüne kadar hemen hemen tüm alanlarda hidroklorik asit kullanılmaktadır.
Nitrik asit, HNO3 kimyasal formülüne sahip oldukça aşındırıcı bir inorganik asittir. Kezzap olarak da bilinir. Saf hâldeki bileşik renksizdir. Ancak uzun süre bekleyen eski asitler azot oksitleri ve suya ayrışması nedeniyle sarı renge dönebilme özelliğindedirler. Piyasada bulunan nitrik asitlerin çoğu % 68'lik bir konsantrasyona sahiptir. Çözelti, %86'dan fazla HNO3 içerdiğinde, dumanlı nitrik asit olarak adlandırılır. Mevcut azot dioksit miktarına bağlı olarak, dumanlı nitrik asit ayrıca %86’nın üzerindeki konsantrasyonlarda kırmızı dumanlı nitrik asit veya %95’in üzerindeki konsantrasyonlarda beyaz dumanlı nitrik asit olarak tanımlanır.
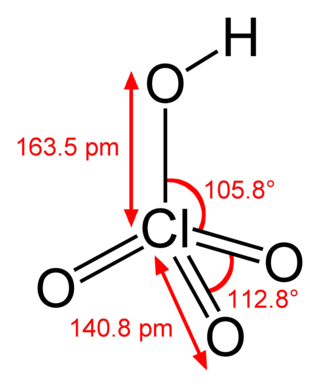
Perklorik asit, HClO4, suda çözünebilen renksiz bir sıvı olan bir klor oksoasididir. Sülfürik asit ya da nitrik asit ile kıyaslanabilecek kadar güçlü bir asittir. Perklorik asit bir süper asittir ancak en güçlü Brønsted-Lowry asidi değildir (en güçlüsü HSbF6 ya da floroantimonik asittir). Asidin pKa'sı −7'dir.

Klorik asit (HClO3), klorun bir oksoasiti ve klorat tuzlarının formal öncülüdür. Güçlü bir asit (pKa ≈1) ve oksitleyici ajandır.

Kükürtlü asit, sülfüröz asit ya da sülfürik(IV) asit formüllü H2SO3 olan bir kimyasal bileşiktir.
Kimyasal reaktiflik, bir reaksiyonun meydana gelme eğilimiyle ilişkilidir. Kimyasal tepkimelerin gerçekleşmesini belirleyen faktörler termodinamik düzeyinde incelenir. Termodinamik olarak bir reaksiyon eğer tepkimenin ürünleri reaktanlara kıyasla daha düşük serbest enerji düzeyinde ise gerçekleşir. Diğer taraftan Reaktiflik ise genel olarak bir maddenin kimyasal değişikliklere ya da kimyasal tepkimelere girme eğilimine denir. Elementlerin atomik yapısı ve elektronlarının dizilişi elementlerin ve oluşturdukları moleküllerin reaktifliğinde önemli rol oynar. Soygazların örneğin kimyasal olarak çok az reaktiflik gösterdiği belirtilir. Dolayısıyla kimyasal bileşik oluşturmaları zordur. Bu durum soygazların tam dolu olan en dış elektron kabuğundan dolayıdır.
Kimyasal denge, asit ve baz kimyası, elektron aktarımı tepkimesi ve entropi gibi konular kimyasal reaktifliğin temel kavramlarıdır.
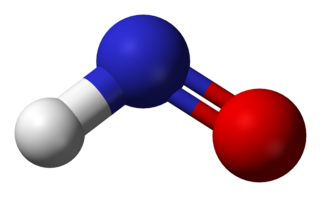
Nitroksil veya azanon, HNO kimyasal bileşiğidir. Gaz fazında iyi bilinmektedir. NO− İndirgenmiş nitrik oksit formudur (NO) ve dioksijen ile izoelektroniktir. Nitroksil, bir reaksiyon ara maddesi olarak oluşturulabilir.

Kloröz asit, HClO2 formülüne sahip bir inorganik bileşiktir. Zayıf bir asittir. Klor, bu asitte +3 oksidasyon durumuna sahiptir. Saf madde dengesiz, hipokloröz aside (Cl oksidasyon hali + 1) ve klorik aside (Cl oksidasyon hali + 5) orantısızdır:
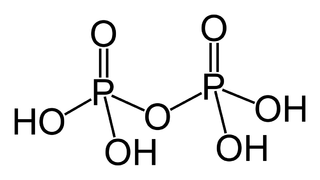
Difosforik asit olarak da bilinen pirofosforik asit, H4P2O7 formülüne sahip inorganik bir bileşik veya daha açıklayıcı olarak [(HO)2P(O)]2O'dur. Renksiz ve kokusuzdur, su, dietil eter ve etil alkolde çözünür. Susuz asit, 54.3 °C ve 71.5 °C'de eriyen iki polimorf içinde kristalleşir. Bileşik, polifosforik asit ve pirofosfat anyonunun konjugat asidinin bir bileşeni olması dışında özel olarak yararlı değildir. Pirofosforik asit anyonları, tuzları ve esterlerine pirofosfatlar denir.

Arsenöz asit (veya arsenik oksit), H3AsO3 formülüne sahip bir inorganik bileşiktir. Sulu çözeltilerde meydana geldiği bilinmektedir, ancak bu gerçek As(OH)3'ün öneminden uzaklaşmasa da saf bir malzeme olarak izole edilmemiştir.
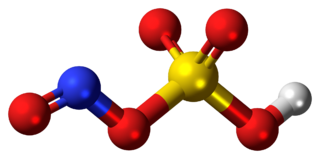
Nitrozilsülfürik asit, NOHSO4 formülüne sahip bir kimyasal bileşiktir. Endüstriyel olarak kaprolaktam üretiminde kullanılan renksiz bir katıdır. Daha önce sülfürik asit üretmek için öncü oda işleminin bir parçasıydı. Bileşik, sülfürik asit ve nitröz asidin karışık anhidritidir.

Tellüröz asit, H2TeO3 formülüne sahip bir inorganik bileşiktir. Tellürün (IV) oksoasididir. Bileşik iyi karakterize edilmemiştir. Formülünü yazmanın alternatif bir yolu (HO)2TeO'dur. Prensip olarak, tellüröz asit, tellür dioksitin su ile, yani hidrolizle işlenmesiyle oluşacaktır. İlgili konjugat bazı, potasyum hidrojen tellürit (KHTeO3) gibi çeşitli tuzlar formunda iyi bilinmektedir.

Disülfürik asit veya pirosülfürik asit, kükürtün bir oksoasitidir. Oleumun önemli bir bileşenidir ve çoğu kimyager bu şekilde karşılaşır. Aynı zamanda, dengeye bağlı olarak sıvı susuz sülfürik asidin küçük bir bileşenidir:
- H2SO4 ⇌ H2O + SO3
- SO3 + H2SO4 ⇌ H2S2O7

Kloroplatinik asit (hekzakloroplatinik asit olarak da bilinir), [H3O]2[PtCl6](H2O)x (0≤x≤6) formülüne sahip bir inorganik bileşiktir. Kırmızı bir katı, genellikle sulu bir çözelti olarak önemli bir platin kaynağıdır. Genellikle kısaca H2PtCl6 olarak yazılsa da, hekzakloroplatinat anyonunun (PtCl62-) hidronyum (H3O+) tuzudur. Hekzakloroplatinik asit oldukça higroskopiktir.

Bromöz asit, HBrO2 formülüne sahip bir inorganik bileşiktir. Konjugat bazının -bromitlerinin- tuzları izole edilmiş olmasına rağmen, kararsız bir bileşiktir. Asidik çözeltide, bromitler broma ayrışır.

İzosiyanik asit, 1830'da Liebig ve Wöhler tarafından keşfedilen HNCO formülüne sahip bir kimyasal bileşiktir. Kaynama noktası 23.5 °C olan uçucu ve zehirli renksiz bir maddedir. İzosiyanik asit, organik kimya ve biyolojide en yaygın olarak bulunan dört element olan karbon, hidrojen, azot ve oksijen içeren en basit kararlı kimyasal bileşiktir.
Hidrojen tellür (tellan), H2Te formülüne sahip bir inorganik bileşiktir. Bir hidrojen kalkojenür ve tellürün en basit hidrürü, renksiz bir gazdır. Ortam havasında kararsız olmasına rağmen, gaz çürümüş sarımsak benzeri kokusu tarafından son derece düşük konsantrasyonlarda kolayca tespit edilebilecek kadar uzun konsantrasyonlarda bulunabilir; ya da çürümüş pırasa benzeri biraz daha yüksek konsantrasyonlarda kokusu ile. Te–H bağları (tellüroller) olan bileşiklerin çoğu, H2 kaybı açısından kararsızdır. H2Te kimyasal ve yapısal olarak hidrojen selenüre benzer, her ikisi de asidiktir. H–Te–H açısı yaklaşık 90° 'dir. Uçucu tellür bileşikleri genellikle çürümüş pırasa veya sarımsak anımsatan hoş olmayan kokulara sahiptir.

Tellürik asit, Te(OH)6 formülüne sahip kimyasal bir bileşiktir. Sulu çözelti içinde devam eden oktahedral Te(OH)6 moleküllerinden oluşan beyaz bir katıdır. Rombohedral ve monoklinik olmak üzere iki formu vardır ve her ikisi de oktahedral Te(OH)6 molekülleri içerir. Tellürik asit, güçlü bazlara sahip tellürat tuzları ve zayıf bazlara sahip hidrojen tellürat tuzları veya sudaki tellüratların hidrolizi üzerine dibazik olan zayıf bir asittir.

Baryum klorür, BaCl2 formüllü inorganik bir bileşik'tir. Bu bileşik baryum'un suda-çözünen en yaygın tuzlarından biridir. Diğer baryum tuzlarının çoğu gibi, baryum klorür beyaz toz halinde ve zehirlidir. Alevde sarı-yeşil renk verir. Ayrıca higroskopiktir, ilk önce dihidrat BaCl2(H2O)2' ye dönüşür.