
Asit, pH derecesi 7'den düşük olup, değişen oranlarda yakıcı ve/veya aşındırıcı özelliğe sahip olan ve oldukça geniş kullanım alanına sahip kimyasal maddelere verilen isimdir. Suda çözündüklerinde hidrojen iyonu derişimini artırarak çözeltiyi asidik yapar. Mavi turnusol kâğıdının rengini kırmızıya çeviren asitlere eski Türkçede hamız veya ekşit denir.

Klor, VIIA grubunda bulunan hafif, keskin kokulu, yeşilimsi sarı renkli, tahriş edici ve zehirleyici bir gaz. Havadan 2,5 kat ağır olan klor ilk zamanlar bir bileşik olarak kabul ediliyordu. Klor ilk olarak 1774 yılında Carl Wilhelm Scheele tarafından keşfedildi. 1810 yılında ise bugünkü ismi Humphry Davy tarafından verildi.

Tuz, kimyada, bir asitle bir bazın tepkimeye girmesi neticesinde meydana gelen maddedir. Tuz, asitteki eksi yüklü iyonla (anyon) bazdaki artı yüklü iyondan (katyon) meydana gelir. Asitle baz arasındaki nötralleşme tepkimesi esnasında tuz ve su açığa çıkar. Erimiş tuz veya çözelti halindeki tuzların çoğu eksi ile artı yüklü iyonlarına ayrışır ve elektriği iletir. Tuz adı ayrıca sofra tuzu veya sodyum klorür (NaCl) için de kullanılır.
Hidroliz işlemi suyu oluşturan hidrojen ve oksijen elementlerinin birbirinden ayrılması ile sonuçlanan bir işlemdir. Bazı kaynaklarda hidroliz, moleküllerin su ilavesiyle daha fazla sayıda parçacık oluşturması olarak da geçer. Hidroliz, su ile bir kimyasal bağın parçalanmasıdır yani bir kimyasal reaksiyondur. Hidroliz genel olarak suyun nükleofil olduğu ikame(yer değiştirme reaksiyonu), eliminasyon(organik reaksiyon türü) ve solvasyon (çözme) reaksiyonları için kullanılır.
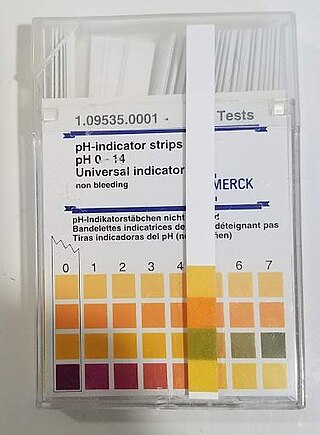
pH, bir çözeltinin asitlik veya bazlık derecesini tarif eden ölçü birimidir. pH'in açılımının ne olduğu kesin olarak bilinmese de genellikle "potential of hydrogen" veya "power of hydrogen" olduğu varsayılır.

Kral suyu, asitlerin az etki ettiği ya da etki etmediği altın ve platin gibi metallerle tepkimeye girebilen kuvvetli bir asit çözeltisidir. Hidroklorik asit ve nitrik asitin 3:1 oranında karıştırılmasıyla oluşur. Ebu Musa Câbir bin Hayyan tarafından bulunduğu tahmin edilmektedir.

Çamaşır suyu, genellikle etken madde olarak sodyum hipoklorit (NaClO) içeren ağartma, temizlik ve hijyen amacıyla kullanılan kimyasal maddedir.
Baz, suda iyonlaştıklarında ortama OH− (hidroksit) iyonu ve elektron çifti verebilen maddelerdir. Bazlar da, asitler gibi tehlikeli maddelerdir. Suda iyonlaştıklarında hidroksit (OH−) iyonu derişimini arttıran maddelere baz denir. Bilinen en güçlü baz Sezyum hidroksittir (CsOH).

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.

Karboksilik asitler karboksil grubu olan organik asitlerdir, -C(=O)OH formülüne sahiptirler, bu genelde -COOH veya CO2H olarak da yazılır. Karboksilik asitler Bronsted asitleridir, yani proton vericileridir. Karboksilik asitlerin tuz ve anyonlarına karboksilat denir. Karboksilik asitler, esterlerle fonsiyonel grup izomeridirler. Karboksilik asitlerin en basit dizisi alkanoik asitlerdir, R-COOH formülüyle gösterilirler, R bir hidrojen atomu veya bir alkil grubuna karşılık gelir. Bileşiklerde birden fazla karboksilik asit grubu bulunabilir.

Hidroklorik asit, hidrojen ve klor elementlerinden oluşan, oda sıcaklığı ve normal basınçta gaz hâlinde olan hidrojen klorürün sulu çözeltisine verilen ad. Halk arasında tuz ruhu olarak da bilinir. 9. yüzyılda simyacı Câbir bin Hayyân tarafından keşfedildi ve sonrasında simya alanında kullanıldı. Sanayi Devrimi sırasında, sanayideki önemi keşfedilen asit, önce Leblanc işlemi, sonrasında Solvay işlemi ile sanayi alanında üretilmeye başladı. Hidroklorik asit, tarihte yeni kolaylıkların keşfinde önemli roller üstlendi. Günümüzde PVC'den demir-çeliğe, organik madde üretiminden gıda sektörüne kadar hemen hemen tüm alanlarda hidroklorik asit kullanılmaktadır.

Diş çürüğü, bakterilerin ürettikleri asitle dişin sert yapısını oluşturan diş minesi, dentin ve sement tabakalarına hasar verdiği bir hastalıktır. Bu dokularda bakterilerin çalışması sonucu zamanla dişlerde kaviteler meydana gelmektedir. İki grup bakterinin bunların meydana gelmesinden sorumlu olduğu düşünülmektedir: Streptococcus mutans ve Lactobacillus.
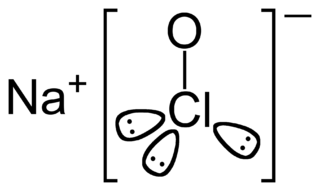
Sodyum hipoklorit, (NaClO) bir tür tuzdur. Günlük hayatta beyazlatıcı çamaşır sularında kullanılmaktadır. Oda koşullarındaki klor ile sabunlardaki sodyum hidroksit tepkimeye sokularak üretilmektedir.

Genellikle metabisülfit olarak bilinen bir disülfit, disülfit iyonu (metabisülfit iyonu) [S2O5]−2 içeren bir kimyasal bileşiktir.
Metabolik alkaloz, dokudaki pH'ın normal aralığın (7,35-7,45) üstüne çıkması ile ortaya çıkan metabolik durumdur. Bu hidrojen iyonu yoğunluğunun artmasıyla yükselen karbonat artışı veya doğrudan karbonat yoğunluğunun artmasının bir sonucudur.

Azot triklorür, trikloramin olarak da bilinen formülü NCl3 olan kimyasal bileşik. Sarı, yağımsı, keskin kokulu bir sıvıdır. En sık amonyak türevleri ve klor arasındaki kimyasal reaksiyon sonrası oluşmaktadır, yüzme havuzlarındaki oluşumu buna bir örnektir.

İyodik asit, HIO3, beyaz veya kirli beyaz bir katı madde olarak elde edilebilir. Suda çok iyi çözünür, ancak klorik asit veya bromik asidin aksine saf halde bulunur. İyodik asit +5 oksidasyon durumunda iyot içerir ve halojenlerin saf halde en stabil okso-asitlerinden biridir. İyot asidi dikkatle ısıtıldığında pentoksit iyice dehidre olur. Daha sonraki ısıtmada, iyot pentoksit ayrıca iyot, oksijen ve düşük iyot oksitleri karışımı vererek ayrışır.
Kimya ve biyokimyada ayrışma, moleküllerin (veya tuzlar veya bileşikler gibi iyonik bileşiklerin) atomlar, iyonlar veya radikaller gibi daha küçük parçacıklara ayrıldığı genel bir süreçtir. Örneğin, bir asit suda çözündüğünde, bir elektronegatif atom ile bir hidrojen atomu arasındaki kovalent bir bağ, bir proton (H+) ve bir negatif iyon veren heterolitik fisyon tarafından kırılır. Ayrışma, birleşme veya rekombinasyonun tersidir.
Klor, günümüzde suyun dezenfeksiyonu amacıyla en sık kullanılan kimyasal maddedir. Klor suda genellikle elemental klor (Cl2, Klor gazı), Kalsiyum Hipoklorit (Ca(ClO)2) veya sodyum hipoklorit solüsyonu (NaClO, çamaşır suyu) şeklinde uygulanmaktadır.Ayrıca klorun Türkiye'de en sık kullanılan formu, sodyum hipoklorittir. Bu uygulamaların her biri ise suda serbest klor oluşumuna neden olmaktadır.Klor basınçlı tanlarda sıvılaştırılmış gaz halinde taşınır ve depolanır.Klor doğru dozajda yapıldığında mikroorganizmaların membranına etki ederek,buradaki proteinlerin yapısında bulunan aminoasitlerden kloraminler meydana getirmek amacıyla mikroorganizmaların çoğalma ve gelişmelerini önler.Kuvvetli oksidan etkiye sahip ve korozyona yol açan bir dezenfektandır.Klorun doz artışıyla birlikte korozif etkisi de belirgin olarak artmaktadır. Klor ile dezenfeksiyonun çevresel etkileri şöyledir;
- Kalsiyum hipoklorür yangın ve patlama tehlikelerine neden olabilir.
- ClO2 in ortamda, az miktarda klorlu maddeler oluşturduğu fakat bunun yanı sıra zehirli bir madde olan kloriti meydana getirdiği gözlenmiştir.Klorit ise kanda bulunan hemoglobini okside ederek vücuttaki görevini yapamaz duruma getirmektedir.
- Suya yeterli miktarda klor ilave edilmelidir. Daha fazla kullanılması hâlinde suyun lezzet ve kokusunu bozar.Bu da istenmeyen bir durumdur.
- Klor gazı çok zehirli ve tahriş edici bir gazdır. Bilinçli olarak kullanmak gerekir.
- Korozif etkisinden dolayı metallerin ve boyaların şeklini,yapısını bozabilir.Suların taşınmasını zorlaştırabilir.

Sodyum klorür, yaygın olarak 'tuz' ismiyle bilinen kimyasal formülü NaCl; 1/1 oranında sodyum ve klorür iyonları olan iyonik bileşik. Molar kütleleri sırasıyla 22.99 ve 35.45 g/moldur. 100 g NaCl, 39.34 g Na ve 60.66 g Cl içerir. Sodyum klorür, deniz suyunun tuzluluğundan ve birçok çok hücreli organizmanın hücre dışı sıvısından en çok sorumlu olan tuzdur. Yenilebilir sofra tuzu biçiminde yaygın olarak bir çeşni ve gıda koruyucusu olarak kullanılır. Birçok endüstriyel proseste büyük miktarlarda sodyum klorür kullanılır ve daha ileri kimyasal sentezler için hammadde olarak kullanılan sodyum ve klor bileşiklerinin ana kaynağıdır. Sodyum klorürün ikinci bir ana uygulaması donma sıcaklığı altındaki havalarda yolların buzunun çözülmesidir.

















