Rubidyum, Rb sembolü ile gösterilen, 37 atom numarasına sahip alkali metaller grubundan bir kimyasal element. 1861 yılında Gustav Kirchhoff ve Robert Bunsen tarafından Almanya'da keşfedilmiştir. Kimyasal açıdan potasyum ve sezyumun özelliklerine benzer özellikler gösterir ama potasyuma oranla çok ender bulunur. Oda sıcaklığında gümüşi beyaz renkli, yumuşak ve parlak bir katıdır. Kuru havada bile çok çabuk yükseltgenir, bu yüzden açık havada saklanamaz. Suyu şiddetle ayrıştırır ve ortaya çıkan hidrojeni tutuşturur.

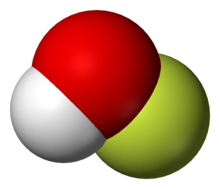
Flor, atom numarası 9, atom ağırlığı 19, yoğunluğu 1,265 olan, kokusu ozonu andıran, kahverengimsi sarı renkte, halojenler grubunun ilk elementidir. 1529 yılında Georgius Agricola, kalsiyum florür bileşiğini tanımlamıştır. İlk defa 1886 yılında Henri Moissan tarafından izole edilmiştir.

Oksijen atom numarası 8 olan ve O harfi ile simgelenen kimyasal elementtir. Oksijen ismi Yunanca ὀξύς (oxis - "asit", tam anlamıyla "keskin", asitlerin acı tadı kastedilir) ve -γενής (-genēs) ("üretici", tam anlamıyla "sebep olan şey") köklerinden gelmektedir, çünkü isimlendirildiği zamanlarda tüm asitlerin oksijen içerikli olduğu sanılırdı. Standart şartlar altında, elementin iki atomu bağlanarak çok soluk mavi renkte, kokusuz, tatsız, diatomik yapıdaki, O2 formülüne sahip dioksijen gazını oluşturur.

Redoks atomların oksidasyon durumlarının değiştiği bir tür kimyasal reaksiyondur. Redoks reaksiyonları, kimyasal türler arasında elektronların fiili veya biçimsel aktarımı ile karakterize edilir, çoğunlukla bir tür oksidasyona, diğer türler indirgemeye uğrar. Elektronun çıkarıldığı kimyasal türlerin indirgenmiş olduğu söyleniyor. Başka bir deyişle:
- Oksidasyon, elektronların bir atom ya da molekülden ayrılmasını sağlayan kimyasal tepkimedir.
- Redüksiyon, bir atomun elektron almasını sağlayan kimyasal tepkimedir.
Nitrik asit, HNO3 kimyasal formülüne sahip oldukça aşındırıcı bir inorganik asittir. Kezzap olarak da bilinir. Saf hâldeki bileşik renksizdir. Ancak uzun süre bekleyen eski asitler azot oksitleri ve suya ayrışması nedeniyle sarı renge dönebilme özelliğindedirler. Piyasada bulunan nitrik asitlerin çoğu % 68'lik bir konsantrasyona sahiptir. Çözelti, %86'dan fazla HNO3 içerdiğinde, dumanlı nitrik asit olarak adlandırılır. Mevcut azot dioksit miktarına bağlı olarak, dumanlı nitrik asit ayrıca %86’nın üzerindeki konsantrasyonlarda kırmızı dumanlı nitrik asit veya %95’in üzerindeki konsantrasyonlarda beyaz dumanlı nitrik asit olarak tanımlanır.
Floroantimonik asit (HSbF6) hidrojen florür ve antimon pentaflorürün farklı oranlardaki karışımıdır. Bu karışımlardan 1:1 kombinasyonu, bilinen en güçlü süperasit formunu oluşturur. Öyle ki, bu form, hidrokarbonları iyonize ederek karbokatyonlar ve H2 oluşturabilmektedir.

Ksenik asit, suyun içinde ksenon trioksitin dağılması ile oluşan bir soy gaz bileşiğidir. Kimyasal yapısı H2XeO4 olan ksenik asit, çok güçlü bir oksitleyici maddedir. Büyük miktarda ksenon, oksijen ve ozon gibi gazlar ürettiği için ayrışımı tehlikelidir.

Florokarbonlar, bazen perflorokarbon veya PFC olarak da anılır, CxFy formülüne sahip organoflor bileşikleridir. Sadece karbon ve flor içerirler fakat terminoloji her zaman çok sıkı takip edilmemektedir. Perfloro- ön ekine sahip bileşikler, heteroatomlu olanlar da dâhil olmak üzere hidrokarbonlardır, burada tüm C-H bağları C-F bağlarıyla değiştirilmiştir. Florokarbonlar perfloroalkanlar, floroalkenler ve floroalkinler ve perfloroaromatik bileşikler olabilir. Florokarbonlar ve bunların türevleri floropolimerler, soğutucular, çözücüler ve anestezikler olarak kullanılır.

İyot monoklorür ICl formülü ile gösterilen bir interhalojen bileşiktir. Oda sıcaklığına yakın eriyen kırmızı-kahverengi renge sahip bir kimyasal bileşiktir. İyot ve klorun elektronegatifliği arasındaki fark nedeniyle, ICl oldukça kutupsaldır ve I+ kaynağı olarak davranır.
Florosülfürik asit (IUPAC adı: sülfürofloridik asit), HSO3F kimyasal formüllü bir inorganik bileşiktir. Ticarî olarak temin edilebilen en güçlü asitlerden biridir. HSO3F formülü sülfürik asit (H2SO4) ile ilişkisini vurgulamaktadır. HSO3F tetrahedral bir moleküldür. Ticari numuneler genellikle sarı olmasına rağmen renksiz bir sıvıdır.

Fülminik asit, HCNO moleküler formülünü içeren kimyasal bir bileşiktir. Gümüş tuzu, 1798'de, gümüş nitrik asit içinde eritildiyse ve şarabın ruhuna eklenen çözeltinin, beyaz, oldukça patlayıcı bir toz elde edildiğini tespit eden Luigi Valentino Brugnatelli tarafından keşfedildi. 1800'de Edward Charles Howard da gümüş tuzu üretti ve daha sonra 1824'te Justus von Liebig tarafından araştırıldı. Howard ayrıca, 1799'da, Brugnatelli'nin işleminde gümüş yerine gümüş cıvası olan cıva tuzunu yarattı. Organik bir asit ve gümüş tuzu 1825'te Friedrich Wöhler tarafından keşfedilen izosiyanik asit izomeridir. Serbest asit ilk olarak 1966'da izole edildi.
Organik kimyada sikloalkin, bir alkinin siklik analoğudur. Bir sikloalkin, bir veya daha fazla üçlü bağ içeren, kapalı bir karbon atomu halkasından oluşur. Sikloalkinlerin genel formülü CnH2n-4 tür. C–C≡C–C alkin biriminin doğrusal doğası nedeniyle, sikloalkinler yüksek oranda zorlanabilir. Yalnızca, halkadaki karbon atomlarının sayısı, bu geometriyi karşılamak için gerekli esnekliği sağlayacak kadar fazla olduğunda mevcut olabilir. Bu molekül sınıfının en küçük bileşenleri deneysel olarak gözlemlenemeyecek kadar çok zorlanma yaşayabilirken, büyük alkin içeren karbosikllerde zorlanma gözlenmez. Siklooktin (C8H12), izole edilebilen ve stabil bir bileşik olarak depolanabilen en küçük sikloalkin grubudur. Bununla birlikte, daha küçük sikloalkinler, diğer organik moleküller ile reaksiyonlar yoluyla veya geçiş metallerine kompleksleşme yoluyla üretilebilir ve hapsedilebilir.
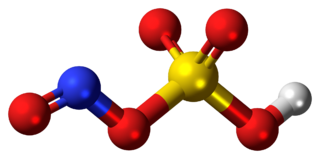
Nitrozilsülfürik asit, NOHSO4 formülüne sahip bir kimyasal bileşiktir. Endüstriyel olarak kaprolaktam üretiminde kullanılan renksiz bir katıdır. Daha önce sülfürik asit üretmek için öncü oda işleminin bir parçasıydı. Bileşik, sülfürik asit ve nitröz asidin karışık anhidritidir.
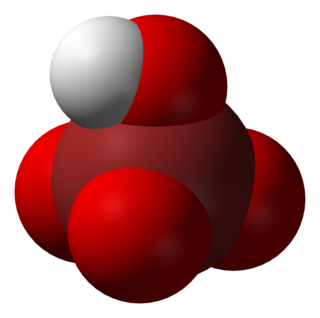
Perbromik asit, HBrO4 formülüne sahip bir inorganik bileşiktir. Bir brom oksoasitidir. Perbromik asit kararsızdır ve periyodik asit hazırlandıkça klorun perklorik asitten yer değiştirmesi ile oluşturulamaz; sadece perbromat iyonunun protonlanması ile yapılabilir.

Kloroplatinik asit (hekzakloroplatinik asit olarak da bilinir), [H3O]2[PtCl6](H2O)x (0≤x≤6) formülüne sahip bir inorganik bileşiktir. Kırmızı bir katı, genellikle sulu bir çözelti olarak önemli bir platin kaynağıdır. Genellikle kısaca H2PtCl6 olarak yazılsa da, hekzakloroplatinat anyonunun (PtCl62-) hidronyum (H3O+) tuzudur. Hekzakloroplatinik asit oldukça higroskopiktir.

Bromöz asit, HBrO2 formülüne sahip bir inorganik bileşiktir. Konjugat bazının -bromitlerinin- tuzları izole edilmiş olmasına rağmen, kararsız bir bileşiktir. Asidik çözeltide, bromitler broma ayrışır.

İzosiyanik asit, 1830'da Liebig ve Wöhler tarafından keşfedilen HNCO formülüne sahip bir kimyasal bileşiktir. Kaynama noktası 23.5 °C olan uçucu ve zehirli renksiz bir maddedir. İzosiyanik asit, organik kimya ve biyolojide en yaygın olarak bulunan dört element olan karbon, hidrojen, azot ve oksijen içeren en basit kararlı kimyasal bileşiktir.
Nitrolama bir nitro grubunun organik kimyasal bileşik içine sokulması için genel bir kimyasal proses sınıfıdır. İfade daha genel olarak, ayrıca nitrogliserin sentezinde olduğu gibi alkoller ve nitrik asit arasında farklı nitrat esterleri oluşturma işlemine yanlış olarak uygulanır. Nitro bileşiklerinin ve nitratların ortaya çıkan yapısı arasındaki fark nitro bileşiklerindeki azot atomunun doğrudan oksijen olmayan bir atoma genel olarak da karbon veya başka azot atomuna bağlanmasıdır. Oysaki organik nitratlar olarak da adlandırılan nitrat esterlerinde, azot bir oksijen atomuna genellikle dolayısıyla da bir karbon atomu 'na bağlanır.
4-Nitrobenzoik asit C6H4(NO2)CO2H formül üne sahip bir organik bileşiktir. Soluk sarı renkli bir katıdır. Anestezik prokain ve folik asitin öncül maddesi olan 4-nitrobenzoil klorür kimyasal bileşiğinin öncül maddesidir. Aynı zamanda, 4-aminobenzoik asit kimyasal bileşiğinin öncül maddesidir.
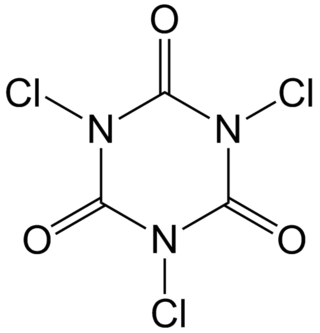
Trikloroizosiyanürik asit, C
3Cl
3N
3O
3 formülüne sahip organik bir bileşiktir. Endüstriyel dezenfektan, ağartma maddesi ve organik sentezde reaktif olarak kullanılır. Güçlü bir klor kokusuna sahip olan bu beyaz kristal toz, bazen evsel ve endüstriyel kullanım için tablet veya granül formunda satılmaktadır.