
Elektron dizilimi, atom fiziği ve kuantum kimyasında, bir atom ya da molekülün elektronlarının atomik ya da moleküler orbitallerdeki dağılımıdır. Örneğin Neon atomunun elektron dizilimi 1s2 2s2 2p6 olarak gösterilir.

Sör John Edward Lennard-Jones İngiliz bir matematikçi ve Bristol Üniversitesi'nde teorik fizik ve ardından Cambridge Üniversitesi'nde teorik bilim profesörü idi. Modern hesaplamalı kimyanın, günümüz sayısal kimya alanının kurucusu olarak kabul edilebilir.

Floresans, soğuk cisimlerde moleküler fotonun yutulmasının daha uzun bir dalga boyunda diğer bir fotonun yayılmasını tetiklemesiyle gerçekleşen ışık verme (ışıma) olayıdır. Yutulan ve yayılan fotonlar arasındaki enerji farkı moleküler titreşimler ya da ısı olarak ortaya çıkar.
İnert madde terimi kimyada, kimyasal olarak aktif olmayan maddeleri nitelemek için kullanılır. Örneğin; soy gazlar, yani periyodik tablonun 8A grubunda yer alan elementler, hiçbir madde ile reaksiyon vermediklerinden dolayı inert maddeler olarak nitelendirilirler. İnert olan maddelerin hiçbir reaksiyona girmemelerinin nedeni de, son orbitallerinin tamamiyle elektron ile dolu olması olarak gösterilmektedir. Bu doluluk sonucunda da bu tür maddeler, elektron kaybetmek veya kazanmak istemezler ve bunun sonucunda da yanma, birleşme gibi hiçbir şekilde kimyasal tepkimelere girmezler.

Salen, organometalik kimyada ve koordinasyon kimyasında kullanılan bir bileşiktir. İsmi salisilik aldehit ve etilendiamin kelimelerinin birleşmesinden meydana gelen bir kısaltmadır, çünkü bu bileşiklerin birleşmesi ile oluşmaktadır.

Ligand ya da ligant, bir biyomoleküle bağlanarak bir kompleks oluşturan bir bileşiktir. Genelde, iyonik bağlar, hidrojen bağları veya Van der Waals güçleri ile hedef bir proteindeki bağlanma yerine bağlanır. Ligand molekülün bağlanma yerine yanaşması genelde tersinir, yani birleşme ve ayrışma arasında bir denge vardır. Biyolojik sistemlerde bir ligandın hedef molekülü ile tersinmez kovalent bağlanması enderdir. İnorganik kimyadaki ligand tanımından farklı olarak, ligandın mutlaka bir metale bağlanması şart değildir. Sinyal reseptörlerine bir ligand bağlanınca reseptör proteinin üç boyutlu şekli değişebilir, bu da onun işlevsel özelliğini değiştirir. Bağlanma eğilimi veya gücüne "afinite" denir. Ligand tipleri arasında substratlar, inhibitörler, aktivatörler ve nörotransmitterler sayılabilir. Radyoligandlar, radyoizotopla işaretlenmiş bileşiklerdir, ligand bağlanma ölçümlerinde kullanılırlar.

Kimyada istiflenme, genelde aromatik olan moleküllerin atomlar arası etkileşerek deste şeklinde üst üst üste gelmesidir. İstiflenmiş bir sistemin en yaygın bilinen örneği DNA molekülünde birbirini takibeden bazlarda görülür. İstiflenme proteinlerde, non-polar iki halkanın örtüşmesi halinde de meydana gelir. Hangi moleküllerarası kuvvetlerin istiflenmeye neden olduğu hâlen tartışma konusudur.

Rudolph "Rudy" Arthur Marcus Kanada doğumlu ABD vatandaşı kimyager. 1992 yılında elektron transferi teorisi için Nobel Kimya Ödülü'nü kazanmıştır. Elektron transfer reaksiyonlarının oranlarının açıklandığı Marcus teorisi, onun adına istinaden bu şekilde adlandırılmıştır.

Venkatraman "Venki" Ramakrishnan Hindistan doğumlu ABD ve Birleşik Krallık vatandaşı yapısal biyolog. 2009 yılında "ribozomun yapısı ve fonksiyonu" konulu çalışmalarıyla Thomas A. Steitz ve Ada E. Yonath ile birlikte Nobel Kimya Ödülü'nü kazandı. Ramakrishnan halihazırda MRC'in Moleküler biyoloji laboratuvarında Cambridge, İngiltere'de çalışmaktadır.

Moleküler dinamik (MD), atomların ve moleküllerin fiziksel hareketlerini incelemek için bir bilgisayar simülasyon yöntemidir. Atomların ve moleküllerin sabit bir süre boyunca etkileşime girmesine izin verilir ve bu da sistemin dinamik evrimi hakkında bilgi verir. En yaygın versiyonda, atomların ve moleküllerin yörüngeleri, parçacıklar ve bunların potansiyel enerjileri arasındaki kuvvetlerin çoğu zaman atomlararası potansiyeller veya moleküler mekanik kuvvet alanları kullanılarak hesaplandığı, etkileşen parçacıkların bir sistemi için Newton'un hareket denklemlerinin sayısal olarak çözülmesiyle belirlenir. Metot ilk olarak 1950'lerin sonunda teorik fizik alanında geliştirildi, ancak günümüzde çoğunlukla kimyasal fizik, malzeme bilimi ve biyomoleküllerin modellenmesinde uygulanmaktadır.

Katı hal fiziğinde, bir katının elektron kuşak yapısı ; katıdaki bir elektronun sahip olabileceği enerji aralıkları ya da sahip olamayacağı enerji aralıkları olarak tanımlanır. Enerji bant teorisi bu bant ve bant boşluklarını atom veya moleküllerin büyük periyodik kafeslerindeki bir elektron için, izinli kuantum mekaniksel dalga fonksiyonlarını inceleyerek çıkarır. Bant teorisi katıların birçok fiziksel özelliklerini; örneğin elektriksel direnç ve optik soğurum gibi, açıklamak için başarılı bir biçimde kullanılmaktadır ve katı hal cihazları anlamanın temelini oluşturmaktadır.
Hesaplamalı kimya, kimya problemlerini çözmeye yardımcı olmak için bilgisayar simülasyonunu kullanan bir kimya dalıdır. Moleküllerin, katıların yapı ve özelliklerini hesaplamak için verimli bilgisayar programlarına dahil edilmiş teorik kimya yöntemlerini kullanır. Bu yöntemlerin kullanılmasının nedeni, hidrojen moleküler iyonu ile ilgili nispeten yeni sonuçlar dışında, kuantum çok-gövdeli(many-body) problemlerin analitik olarak çözülemez oluşudur. Hesaplama sonuçları normal olarak kimyasal deneylerle elde edilen bilgileri tamamlarken, bazı durumlarda gözlemlenmeyen kimyasal olayları da tahmin edebilmektedir. Yeni ilaç ve materyallerin tasarımında yaygın olarak kullanılmaktadır.

Kimyada, doğrusal moleküler geometri 180°'lik bir açıya yerleştirilmiş diğer iki atoma bağlanmış merkezi bir atom etrafındaki geometriyi tarif eder. Asetilen (HC≡CH) gibi doğrusal organik moleküller genellikle karbon merkezleri için sp orbital hibridizasyonu teşvik edilerek tarif edilir.
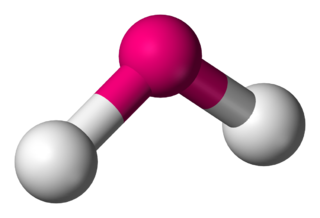
Kimyada, " açısal" ya da "bükülmüş" terimi bazı moleküllere moleküler geometrilerini tanımlamak için kullanılabilir. Oksijen gibi bazı atomlar, Elektron dizilimi nedeniyle hemen hemen her zaman iki (veya daha fazla) kovalent bağını doğrusal olmayan yönlerde ayarlarlar. Su (H2O), analoglarının yanı sıra açısal bir molekül örneğidir. İki hidrojen atomu arasındaki bağ açısı yaklaşık olarak 104,45°'dir. Doğrusal olmayan geometri genel olarak sadece ana grup elementleri içeren diğer üç atomlu molekülleri ve iyonlar için gözlemlenir, belirgin örnekler: Azot dioksit (NO2), kükürt diklorür (SCL2) ve metilen (CH2).

Kimyada, üçgen düzlemsel, merkezde bir atom ve birer üçgenin köşelerinde üç atom olan ve hepsi bir düzlemde çevresel atomlar olarak bulunduğu bir moleküler geometri modelidir. İdeal bir üçgen düzlemsel türde, üç ligand aynıdır ve bütün bağ açıları 120°'dir. Bu türler D3h nokta grubuna aittir. Üç ligandın aynı olmaadığı H2CO gibi moleküller, bu ideal geometri sapma gösterir. Üçgen düzlemsel bir şekle sahip moleküller arasında boron triflorür (BF3), formaldehit (H2CO), fosgen (COCl2) ve kükürt trioksit (SO3) bulunmaktadır. Üçgen düzlem geometrisi olan bazı iyonlar arasında nitrat (NO3-), karbonat (CO3−2) ve guanidinyum (C(NH2)3+)) bulunmaktadır. Organik kimyada, üçgen düzlemsel olarak karbon merkezlerine üç bağlı atomun bulunduğu moleküller çoğunlukla sp2 hibridizasyona sahip olarak tarif edilmiştir.

Moleküler modelleme alanında, yanaştırma, bir molekülün ikinci bir moleküle kararlı bir kompleks oluşturmak için birbirine bağlandığında bağlandığında tercih ettiği oryantasyonu tahmin eden bir yöntemdir. Tercih edilen oryantasyon bilgisi iki molekül arasındaki birleşme veya bağlanma afinitesini tahmin etmek için kullanılabilir.
Protein–ligand yanaştırma bir moleküler modelleme tekniğidir. Protein–ligand yanaştırmanın amacı, bir ligandın bir protein reseptörüne veya enzime bağlandığındaki konumunu ve oryantasyonunu tahmin etmektir. Farmasötik araştırma, çeşitli amaçlarla, özellikle de olası ilaç adaylarını seçmek için mevcut kimyasalların geniş veritabanlarının sanal taranmasında, yanaştırma tekniklerini kullanır.

Moleküler modelleme, moleküllerin davranışını modellemek veya taklit etmek için kullanılan teorik ve bilgisayarlı tüm yöntemleri kapsar. Bu yöntemler, küçük kimya sistemlerinden büyük biyolojik moleküllere ve malzeme gruplarına kadar değişen moleküler sistemleri incelemek için bilgisayarlı kimya, ilaç tasarımı, bilgisayarlı biyoloji ve malzeme bilimi alanlarında kullanılmaktadır. En basit hesaplamalar elle yapılabilir, ancak kaçınılmaz olarak makul büyüklükteki herhangi bir sistemin moleküler modellemesini bilgisayarların yapması gerekir. Moleküler modelleme yöntemlerinin ortak özelliği, moleküler sistemlerin atom düzeyinde tanımlanmasıdır. Bu, atomları en küçük bireysel birim olarak muamele edilmesini içerebilir veya protonları ve nötronları kuarkları, kuarkları, gluonlarıyla beraber ve elektronları da fotonlarıyla beraber açıkça modellemeyi içerebilir.

Kimyada, oktahedral moleküler geometri, bir oktahedronun köşelerini tanımlayan, merkezi bir atom etrafında simetrik olarak düzenlenmiş altı atomlu bileşiklerin veya atom gruplarının veya ligandların şeklini tanımlar. Oktahedronun sekiz yüzü vardır, dolayısıyla octa ön ekini alır. Oktahedron, Platonik katılardan biridir, ancak oktahedral moleküller tipik olarak merkezlerinde bir atom içerir ve ligand atomları arasında bağ yoktur. Mükemmel bir oktahedron Oh nokta grubuna aittir. Oktahedral bileşiklerin örnekleri arasında kükürt hekzaflorür SF6 ve molibden hekzakarbonil Mo (CO)6 gösterilebilir. "Oktahedral" terimi, kimyagerler tarafından, merkezi atoma olan bağların geometrisine odaklanarak ve ligandların kendi aralarındaki farklılıkları dikkate almadan biraz gevşek bir şekilde kullanılır. Örneğin, N-H bağlarının oryantasyonu nedeniyle matematiksel anlamda oktahedral olmayan [Co(NH3)6]3+, oktahedral olarak adlandırılır.
Kimyada, elektron verici, elektronları başka bir bileşiğe veren kimyasal oluşumlardır. Verdiği elektronlar sayesinde süreç içinde oksitlenen bir indirgeyici maddedir.


















