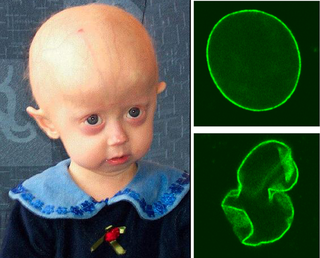
Hücre yaşlanması
Hücre yaşlanması, tüm dokuların ve organların, sonuç olarak tüm bedenin yaşlanmasını getirir. Canlılar, doğumdan sonraki her gün bir gün daha yaşlanır. Yaşlanma, fizyolojik organizasyonun giderek azalması ve organların çalışmalarındaki aksamalarla başlayan ve somatik ölüme dek giden bir süreçtir.[1][2] Yaşlanmayla birlikte çok sayıda hastalık tablosunun oluşmasına yol açan risk faktörleri yoğunlaşır; sonuçta kanserler, diabet, kalp ve damar hastalıkları gibi ölüme neden olabilen patolojiler belirir.[3]
Hücre yaşlanması, bir hücrenin belli bir sayıda mitoz bölünme geçirdikten sonra iç ve/veya dış etkiler sonucu bölünebilme yeteneğini kaybetmesi ile açıklanabilir. Hücre yaşlanmasının çok az görüldüğü (örn. bazı soğukkanlı hayvanlar) veya hiç görülmediği canlılar (örn. çok yıllık bitkiler) da vardır. Hücre yaşlanması ve programlanmış hücre ölümü, DNA kırılması veya toksinlerin etkisi sonucu hücrelerde ileride kansere dönüşebilecek derecede hasar birikmesini engellemek için alternatif savunma mekanizmalarıdır. Kromozom uçlarını koruyan telomerlerin kısalması hücre yaşlanmasının en önemli sebeplerindendir. Örneğin, bazı kanser türleri yeniden etkinleştirdikleri telomeraz sayesinde telomer uzunluklarını koruyarak hücre yaşlanmasından kaçabilmekte ve sınırsız olarak bölünebilmektedirler. Genomik değişkenlik, telomer kısalması, epigenetik değişimler, protein dengelerinin (proteostazis) yitirilmesi, mitokondri işlevlerinde bozulma, hücrelerin yorulması, kök hücrelerin azalması ve hücrelerarası iletişimin bozulması gibi moleküler etkiler yaşlanmanın kökenindeki genetik faktörlerin temelini oluşturur.[1][2][4][5] Yaşlanmanın en önemli nedeni organizmanın kendisinden gelen (endojen) ya da çevresel (ekzojen) faktörlerdir. Ekzojen ya da endojen faktörler akut ve güçlü olduklarında ölümle, küçük miktarlarda ve kronik etkilerini birikerek gösterdiklerinde ise yaşlanmayla son bulurlar. İnsanlar, işte bu nedenle yaşlandıkça çok sayıda dejeneratif hastalıklarla karşılaşırlar.
Yaşlanma hızı
Yaşlanma hızı bireysel farklılıklar gösterir. Yaşlanma hızında etkili olan faktörlerin çoğu etkilerini yoğun serbest radikal oluşmasını tetikleyerek gösterirler.
Yaşlanma hızını etkileyen faktörler için başlıca örnekler şunlardır:[6]
- Kalıtım (erken aklaşan saçlar, metabolik sendromlar)
- Beslenme (aşırı kalori yüklenme, obezite, diabet, ateroskleroz)
- Sosyal çevre (hareketsizlik, stres)
- Toksik maddeler (alkol, sigara, narkotikler)
- Meslek (yıpratıcı meslekler: madenciler, radyasyoncular, vb)
Yaşlanma genetiği
Model sistemler üzerinde yalpan çalışmalar, yaşlanmanın genetik sistemdeki ve protein sentezindeki aksamaların sonucu olduğunu göstermektedir.
DNA zararları, yaşlanma genetiğinde özel bir önem taşır.[1][2][3][5][6]
- Hücre yaşlanması: insanlar yaşlandıkça hücrelerinin yenilenme hızı da düşmektedir. Çocuklardaki hücre yenilenmesi yaşlı bireylere oranla çok hızlı ve sağlıklıdır. Yaşlılardaki hücre yenilenmesi ise “yaşlanma olgusunun aşırı ivme kazandığı” hastalardan daha hızlıdır; örneğin, gen mutasyonuyla ilgili DNA etkilenmeleri sonucu ortaya çıkan Werner sendromunda yaşlanma belirtileri çok erken yıllarda ortaya çıkar.
- Metabolik ve Genetik zararların birikmesi: organizma tarafından onarılamayan ve etkileri birikerek artan faktörlerden oluşan zararlardır. En iyi örnek “serbest oksijen radikalleri (ROS)”dir. Aşırı ROS oluşumu, radyasyon etkisi ve antioksidan (glutathione peroxidase, superoxide dismutase) yetersizliği yaşlanma sürecini aşırı biçimde hızlandırır.
- DNA zararlarının algılanmasındaki ve onarılmasındaki aksamalar: hızlı bir yaşlanma sürecinin önemli nedenlerinden biridir (Werner sendromu, ataxia-telangiectasia hastalığı),
- Hücre organellerinde (proteasome komponenti) aksamalar: hücre yaşlanmasını hızlandırmaktadır.
Yaşam süresinin uzatılmasında öneriler
- Yaşam süresinin uzatılabilmesindeki en somut öneri “Kalori alımının kısıtlanması”dır. Düşük kaloriyle beslenenlerde “sirtuin grubu” proteinlerin aktivitesi artmaktadır.[2]
- Sirtuinler protein sentezini arttırarak apoptozisi engellemekte, metabolizmayı hızlandırmakta, insülin duyarlılığını düzenlemekte ve ROS oluşumunu azaltmaktadır.[2]
- İnsülin ve insülin-benzeri büyüme faktörü (insulin-like growth factor-1; IGF-1) reseptörlerinin mutasyonlarının engellenmesi de yaşam süresini uzatan faktörlerden biri olarak görülmektedir.[2]
- Skuamöz epitel (deri): 10-30 gün
- Skuamöz epitel (ağız; özofagus): 2-3 gün
- Mide: 2-9 gün
- İnce bağırsaklar: 1-4 gün
- Kalın bağırsak: 6 gün
- Eritrositler: 120 gün
- Trombositler: 10 gün
- Nötrofiller: 1-5 gün
- Eozinofiller 2-5 gün
- Kemik iliği kök hücreleri: 2 ay
- Akciğer alveol hücreleri: 8 gün
- Uterus serviksi: 6 gün
- Sperm: 2 ay
- Osteoklastlar: 15 gün
- Hepatosit: 180-400 gün
- Düz kas hücresi: yıllar
- Çizgili kas hücresi: yenilenmez
- Kalp kası hücresi: yenilenmez
- Nöronlar: yenilenmez
Kaynakça
- ^ a b c Knapowski J, Wieczorowska-Tobis K, Witowski J. Pathophysiology of ageing. Journal of Physiology and Pharmacology, 53(2):135-146, 2002
- ^ a b c d e f Hamczyk MR, Nevado RM, Barettino A, et al. Biological Versus Chronological Aging: JACC Focus Seminar. Journal of the American College of Cardiology, 75(8):919-930, 2020
- ^ a b Belikov, AV. Age-related diseases as vicious cycles. Ageing Research Reviews. 49: 11–26, 2019
- ^ Robert L, Labat-Robert J, Robert AM. Genetic, epigenetic and posttranslational mechanisms of aging. Biogerontology. 11 (4): 387–99, 2010
- ^ a b Lopez-Otin C, Blasco MA, Partridge L, et al. The hallmarks of aging. Cell, 153(6): 1194–1217
- ^ a b c Kumar V, Abbas AK, Aster JC. Robbins and Cotran Pathologic Basis of Disease. 9th edt., Elsevier Saunders, Philadelphia, 2015
- ^ Milo R, PhillipsR. Cell Biology by the Numbers. CRC Press, Boca Raton, 2015