Grignard reaktifi

Bir Grignard reaktifi veya Grignard bileşiği, X'in bir halojen ve R'nin normalde bir alkil veya aril olduğu organik bir grup olduğu genel formül R−Mg−X'e sahip kimyasal bir bileşiktir. İki tipik örnek, metilmagnezyum klorür Cl−Mg−CH
3 ve fenilmagnezyum bromür (C
6H
5)−Mg−Br'dir. Organomagnezyum bileşiklerinin bir alt sınıfıdır.
Grignard bileşikleri, yeni karbon-karbon bağları oluşturmak için organik sentezde popüler reaktiflerdir. Örneğin, uygun bir katalizör varlığında başka bir halojenlenmiş bileşik R'−X' ile reaksiyona sokulduğunda, tipik olarak bir yan ürün olarak R−R' ve magnezyum halojenür MgXX' verirler ve sonuncusu normal olarak kullanılan çözücülerde çözünmez. Bu açıdan organolityum reaktiflerine benzerler.
Saf Grignard reaktifleri son derece reaktif katılardır. Normalde dietil eter veya tetrahidrofuran gibi çözücüler içinde, su hariç tutulduğu sürece nispeten kararlı olan çözeltiler olarak ele alınırlar. Böyle bir ortamda, bir Grignard reaktifi, koordinasyon bağları ile iki eter oksijenine bağlanan magnezyum atomu ile bir kompleks halinde değişmez bir şekilde mevcuttur.
1900'de Grignard reaksiyonunun keşfi, 1912'de Nobel ödülü ile ödüllendirildi.
Sentezi
Grignard reaktifleri, bir organik halojenürün (normalde organobromür) magnezyum metali ile işlenmesiyle hazırlanır. Organomagnezyum bileşiğini stabilize etmek için siklik veya asiklik eterler gereklidir. Reaktifi protonoliz veya oksidasyon yoluyla hızla yok eden su ve hava, havasız teknikler kullanılarak hariç tutulur.[1] Reaktiflerin yine de kuru olması gerekmesine rağmen ultrason, magnezyumu su tüketecek şekilde aktive ederek Grignard reaktiflerinin ıslak çözücüler içinde oluşmasına izin verebilir.[2]
Katılar ve çözelti içeren reaksiyonlarda yaygın olduğu gibi, Grignard reaktiflerinin oluşumu genellikle bir indüksiyon süresine tabidir. Bu aşamada magnezyum üzerindeki pasifleştirici oksit uzaklaştırılır. Bu indüksiyon periyodundan sonra reaksiyonlar oldukça ekzotermik olabilir. Laboratuvardan üretim tesisine bir reaksiyon ölçeklendirildiğinde bu ekzotermiklik dikkate alınmalıdır.[3] Çoğu organohalojenür işe yarayacaktır, ancak karbon–flor bağları, özel olarak aktive edilmiş magnezyum dışında (Rieke metalleri aracılığıyla) genellikle reaktif değildir.
Magnezyum
Tipik olarak, Grignard reaktiflerini oluşturmak için reaksiyon, magnezyum şeridinin kullanılmasını içerir. Tüm magnezyum, organik halojenür ile reaksiyonları engelleyen pasifleştirici bir magnezyum oksit tabakası ile kaplanmıştır. Bu pasifleştirici tabakayı zayıflatmak ve böylece yüksek derecede reaktif magnezyumu organik halojenüre maruz bırakmak için birçok yöntem geliştirilmiştir. Mekanik yöntemler, yerinde hızlı karıştırma ve sonikasyon Mg parçalarının ezilmesini içerir.[4] İyot, metil iyodür ve 1,2-dibromoetan yaygın aktive edici maddelerdir. 1,2-dibromoetanın kullanımı, etkisi etilen kabarcıklarının gözlemlenmesiyle izlenebildiği için avantajlıdır. Ayrıca yan ürünler zararsızdır:
- Mg + BrC2H4Br → C2H4 + MgBr 2
Bu aktive edici ajanlar tarafından tüketilen Mg miktarı genellikle önemsizdir. Küçük bir miktar cıva klorür, metalin yüzeyini karıştırarak reaktivitesini artıracaktır. Önceden oluşturulmuş Grignard reaktifinin eklenmesi genellikle başlatıcı olarak kullanılır.
Rieke magnezyum gibi özel olarak etkinleştirilen magnezyum, bu sorunu ortadan kaldırır.[5] Oksit tabakası ayrıca, oksitlenmiş tabakayı kazımak için[6] bir karıştırma çubuğu kullanılarak veya birkaç damla iyot veya 1,2-Diiyodoetan eklenerek ultrason kullanılarak parçalanabilir. Diğer bir seçenek ise süblimleştirilmiş magnezyum veya magnezyum antrasen kullanmaktır.[7]
Mekanizma
Mekanizma açısından, reaksiyon tek elektron transferiyle ilerler:[8][9][10]
- R − X + Mg → R − X • - + Mg • +
- R − X • - → R • + X -
- R • + Mg • + → RMg +
- RMg + + X - → RMgX
Grignard reaktiflerinin test edilmesi
Grignard reaktifleri neme ve oksijene karşı çok hassas olduğu için, bir partinin kalitesini test etmek için birçok yöntem geliştirilmiştir. Tipik testler, tartılabilir, susuz protik reaktiflerle titrasyonları içerir; bir renk göstergesi varlığında mentol. Grignard reaktifinin fenantrolin veya 2,2'-bipiridin ile etkileşimi bir renk değişikliğine neden olur.[11]
Mg transfer reaksiyonu (halojen-Mg değişimi)
Grignard reaktiflerinin alternatif bir preparasyonu, Mg'nin önceden oluşturulmuş bir Grignard reaktifinden organik bir halojenüre transferini içerir. Bu yöntem, Mg transferinin birçok fonksiyonel grubu tolere etmesi avantajını sunar. Tipik bir reaksiyon, izopropilmagnezyum klorür ve aril bromür veya iyodürleri içerir:[12]
- i -PrMgCl + ArCl → i -PrCl + ArMgCl
Grignard reaktiflerinin reaksiyonları
Karbonil bileşikleri ile
Grignard reaktifleri, çeşitli karbonil türevleri ile reaksiyona girer.[13]

Grignard reaktiflerinin en yaygın uygulaması, aldehitlerin ve ketonların alkilasyonudur, yani Grignard reaksiyonu:[14]

Asetal fonksiyonun (korumalı bir karbonil) reaksiyona girmediğini unutmayın.
Bu tür reaksiyonlar genellikle sulu bir asidik çalışmayı içerir, ancak bu adım reaksiyon şemalarında nadiren gösterilir. Grignard reaktifinin bir aldehite veya bir prokiral ketona eklediği durumlarda, Felkin-Anh modeli veya Cram Kuralı genellikle hangi stereoizomerin oluşacağını tahmin edebilir. Kolayca protonu giderilen 1,3-diketonlar ve ilgili asidik substratlar ile Grignard reaktifi RMgX yalnızca enolat anyonu veren ve alkan RH'yi serbest bırakan bir baz olarak işlev görür.
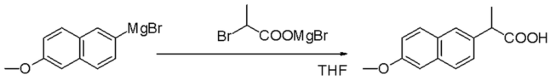
Grignard reaktifleri, endüstriyel Naproksen üretiminde anahtar bir adımda örneğin alkil halojenürlerle nükleofilik alifatik ikamelerde nükleofillerdir:

Baz olarak reaksiyonlar
Grignard reaktifleri, protik substratlar için bir temel görevi görür (bu şema, tipik olarak su içeren çalışma koşullarını göstermez). Grignard reaktifleri baziktir ve alkoksitler (ROMgBr) vermek üzere alkoller fenoller vb. İle reaksiyona girer. Fenoksit türevi, salisilaldehit vermek üzere formilasyon paraformaldehide duyarlıdır.[15]
Metallerin ve metaloidlerin alkilasyonu
Organolityum bileşikleri gibi, Grignard reaktifleri de karbon-heteroatom bağları oluşturmak için kullanışlıdır.
Grignard reaktifleri birçok metal bazlı elektrofil ile reaksiyona girer. Örneğin, dialkilkadmiyum vermek için kadmiyum klorür (CdCl2) ile transmetalasyona uğrarlar:[16]
- 2 RMgX + CdCl 2 → R 2 Cd + 2 Mg (X) Cl
Schlenk dengesi
Grignard reaksiyonlarının çoğu eterli çözücüler, özellikle dietil eter ve THF içinde gerçekleştirilir. Şelatlayıcı dioksan ile bazı Grignard reaktifleri, diorganomagnezyum bileşikleri (R = organik grup, X = halojenür) vermek üzere bir yeniden dağıtım reaksiyonuna girer:
- 2 RMgX + dioksan
 R2, Mg + MgX 2 (dioksan)
R2, Mg + MgX 2 (dioksan)
Bu reaksiyon, Schlenk dengesi olarak bilinir.
Organik halojenürler ile birleştirme
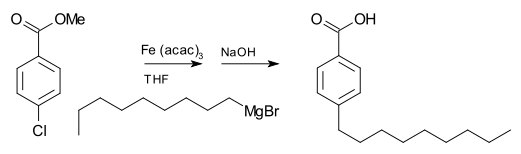
Grignard reaktifleri, diğer ana grup halojenürlerle yüksek reaktivitelerinin aksine, tipik olarak organik halojenürlerle reaksiyona girmez. Metal katalizörlerin varlığında, ancak Grignard reaktifleri C-C birleştirme reaksiyonlarına katılır. Örneğin nonilmagnezyum bromür, aşağıda gösterilen esteri hidrolize etmek için NaOH ile çalıştıktan sonra tris(asetilasetonato)demir(III) (Fe(acac)3) varlığında p-nonilbenzoik asit vermek üzere metil p-klorobenzoat ile reaksiyona girer. Fe(acac)3 olmadan, Grignard reaktifi, aril halojenür üzerinde ester grubuna saldıracaktır.[17]
Aril halojenürlerin aril Grignard reaktifleri ile birleştirilmesi için, tetrahidrofuran (THF) içindeki nikel klorür de iyi bir katalizördür. Ek olarak, alkil halojenürlerin birleştirilmesi için etkili bir katalizör, THF'de lityum klorür (LiCl) ve bakır (II) klorür (CuCl2) karıştırılarak hazırlanan dilityum tetraklorokuprattır (Li2CuCl4). Kumada-Corriu bağlantısı, [ikame edilmiş] stirenlere erişim sağlar.
Oksidasyon
Bir Grignard reaktifinin oksijenle işlenmesi, magnezyum organoperoksiti verir. Bu materyalin hidrolizi, hidroperoksitler veya alkol verir. Bu reaksiyonlar, radikal ara ürünleri içerir.
Alkol vermek için Grignard reaktiflerinin basit oksidasyonu, verimler genellikle zayıf olduğundan pratikte çok az önem taşır. Bunun tersine, daha sonra hidrojen peroksit ile alkole oksitlenen bir boran yoluyla iki aşamalı sekans (yukarıya bakınız), sentetik faydalıdır.
Grignard oksidasyonlarının sentetik faydası, Grignard reaktiflerinin bir alken mevcudiyetinde oksijen ile bir etilen uzatılmış alkole reaksiyonu ile arttırılabilir.[18] Bu modifikasyon, aril veya vinil Grignardlar gerektirir. Sadece Grignard ve alken eklenmesi, oksijen varlığının gerekli olduğunu gösteren bir reaksiyonla sonuçlanmaz. Tek dezavantaj, en az iki eşdeğer Grignard gerekliliğidir, ancak bu kısmen n-bütilmagnezyum bromür gibi ucuz bir indirgeyici Grignard ile ikili bir Grignard sisteminin kullanılmasıyla ortadan kaldırılabilir.

Eliminasyon
Boord olefin sentezinde, belirli-haloeterlere magnezyum eklenmesi, alken için bir eliminasyon reaksiyonu ile sonuçlanır. Bu reaksiyon, Grignard reaksiyonlarının kullanımını sınırlayabilir.

Endüstriyel kullanım
Grignard reaksiyonunun bir örneği, Tamoksifen'in[19] (stereoselektif olmayan) endüstriyel üretiminde (şu anda kadınlarda östrojen reseptörü pozitif meme kanserinin tedavisi için kullanılmaktadır) anahtar bir adımdır:[20]

Galeri
 Magnezyum talaşlar bir şişeye yerleştirilir.
Magnezyum talaşlar bir şişeye yerleştirilir. Tetrahidrofuran ve küçük bir iyot parçası eklenir.
Tetrahidrofuran ve küçük bir iyot parçası eklenir. Isıtma sırasında bir alkil bromür çözeltisi eklenir.
Isıtma sırasında bir alkil bromür çözeltisi eklenir. İlave işlemi tamamlandıktan sonra karışım bir süre ısıtılır.
İlave işlemi tamamlandıktan sonra karışım bir süre ısıtılır. Grignard reaktifinin oluşumu tamamlandı. Şişede hala az miktarda magnezyum kalır.
Grignard reaktifinin oluşumu tamamlandı. Şişede hala az miktarda magnezyum kalır. Bu şekilde hazırlanan Grignard reaktifi, karbonil bileşiğinin eklenmesinden önce 0°C soğutulur. Grignard reaktifi çökelirken çözelti bulanıklaşır.
Bu şekilde hazırlanan Grignard reaktifi, karbonil bileşiğinin eklenmesinden önce 0°C soğutulur. Grignard reaktifi çökelirken çözelti bulanıklaşır. Grignard reaktifine bir karbonil bileşiği çözeltisi eklenir.
Grignard reaktifine bir karbonil bileşiği çözeltisi eklenir. Çözelti, oda sıcaklığına kadar ısıtılır. Bu noktada reaksiyon tamamlandı.
Çözelti, oda sıcaklığına kadar ısıtılır. Bu noktada reaksiyon tamamlandı.
Kaynakça
- ^ Goebel, M. T.; Marvel, C. S. (1933). "The Oxidation of Grignard Reagents". Journal of the American Chemical Society. 55 (4). ss. 1693-1696. doi:10.1021/ja01331a065.
- ^ Smith (1999). "Grignard Reactions in "Wet" Ether". Journal of Chemical Education. 76 (10): 1427. doi:10.1021/ed076p1427.
- ^ Philip E. Rakita (1996). "5. Safe Handling Practices of Industrial Scale Grignard Ragents". Gary S. Silverman; Philip E. Rakita (Ed.). Handbook of Grignard reagents. CRC Press. ss. 79-88. ISBN 0-8247-9545-8.
- ^ Smith, David H. (1999). "Grignard Reactions in "Wet" Ether". Journal of Chemical Education. 76 (10). s. 1427. Bibcode:1999JChEd..76.1427S. doi:10.1021/ed076p1427.
- ^ Lai Yee Hing (1981). "Grignard Reagents from Chemically Activated Magnesium". Synthesis. 1981 (9). ss. 585-604. doi:10.1055/s-1981-29537.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart (2013), "Konformationsanalyse", Organische Chemie, Berlin, Heidelberg: Springer Berlin Heidelberg, ss. 399-423, ISBN 978-3-642-34715-3, erişim tarihi: 17 Kasım 2020
- ^ Wakefield, Basil J. (1995). Organomagnesium Methods in Organic Chemistry. Academic Press. ss. 21-25. ISBN 0080538177.
- ^ Garst, J. F.; Ungvary, F. "Mechanism of Grignard reagent formation".
- ^ Advanced Organic chemistry Part B: Reactions and Synthesis F.A. Carey, R.J. Sundberg 2nd Ed. 1983.
- ^ Garst, J.F.; Soriaga, M.P. "Grignard reagent Formation", Coord.
- ^ Krasovskiy (2006). "Convenient Titration Method for Organometallic Zinc, Harshal ady Magnesium, and Lanthanide Reagents". Synthesis. 2006 (5): 890-891. doi:10.1055/s-2006-926345.
- ^ Knochel (2003). "Highly Functionalized Organomagnesium Reagents Prepared through Halogen–Metal Exchange". Angewandte Chemie International Edition. 42 (36): 4302-4320. doi:10.1002/anie.200300579. PMID 14502700.
- ^ Gilman, Henry; Kirby, R. H. (Ağustos 1941). "Addition Reactions of Organometallic Compounds with Conjugated Systems1". Journal of the American Chemical Society. 63 (8): 2046-2048. doi:10.1021/ja01853a004. ISSN 0002-7863.
- ^ Haugan (1997). "Total Synthesis of C31-Methyl Ketone Apocarotenoids 2: The First Total Synthesis of (3R)-Triophaxanthin" (PDF). Acta Chemica Scandinavica. 51: 1096-1103. doi:10.3891/acta.chem.scand.51-1096. 11 Ağustos 2011 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 26 Kasım 2009.
- ^ Peters (2006). "A Multistep Synthesis for an Advanced Undergraduate Organic Chemistry Laboratory". Journal of Chemical Education. 83 (2): 290. doi:10.1021/ed083p290.
- ^ "Unit 12 Aldehydes, Ketones and Carboxylic Acids" (PDF). Chemistry Part II Textbook for class XII. 2. India: National Council of Educational Research and Training. 2010. s. 355. ISBN 978-81-7450-716-7.
- ^ Fürstner, Alois; Leitner, Andreas; Seidel, Günter (7 Ocak 2005), "4-Nonylbenzoic Acid", Organic Syntheses, Hoboken, NJ, USA: John Wiley & Sons, Inc., ss. 33-41, ISBN 0-471-26422-9, erişim tarihi: 17 Kasım 2020
- ^ Youhei Nobe (2005). "Air-Assisted Addition of Grignard Reagents to Olefins. A Simple Protocol for a Three-Component Coupling Process Yielding Alcohols". J. Am. Chem. Soc. 127 (51): 18006-18007. doi:10.1021/ja055732b. PMID 16366543.
- ^ Richey, Herman Glenn (2000). Grignard Reagents: New Developments. Wiley. ISBN 0471999083.
- ^ Jordan VC (1993). "Fourteenth Gaddum Memorial Lecture. A current view of tamoxifen for the treatment and prevention of breast cancer". Br J Pharmacol. 110 (2): 507-17. doi:10.1111/j.1476-5381.1993.tb13840.x. PMC 2175926 $2. PMID 8242225.
![Reactions of Grignard reagents with non carbon electrophiles {\displaystyle {\begin{matrix}{\ce {R4B-}}\\{\color {White}\scriptstyle {\ce {Et2O.BF3\ or\ NaBF4}}}{\Bigg \uparrow }\scriptstyle {\ce {Et2O.BF3\ veya\ NaBF4}}\\{\ce {Ph2PR<-[{\ce {Ph2PCl}}]RMgX->[{\ce {Bu3SnCl}}]Bu3SnR}}\\{\color {White}\scriptstyle {\ce {B(OMe)3}}}{\Bigg \downarrow }\scriptstyle {\ce {B(OMe)3}}\\{\ce {RB(OMe)2}}\end{matrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/079fa2291fdbe5501d456d3f1309a6ef12d2a3ba)