Kemosentez, ışık enerjisi olmadan organik madde üretilmesidir. Gereken enerji; demir, kükürt, hidrojen veya azot gibi inorganik bileşiklerin veya metanın oksitlenmesiyle elde edilir.

İyot, sembolü I, atom numarası 53 olan bir elementtir. Kimyasal olarak iyot halojenlerin en az reaktif olanı, astatin'den sonra en elektropozitif olanıdır. İyot başlıca tıpta, fotoğrafçılıkta ve boya imalatında kullanılır. Çoğu canlının eser miktarda iyota gereksinimi vardır.

Zirkonyum metali ilk olarak 1789 yılında Martin Heinrich Klaproth tarafından keşfedilmiştir. 1824 yılında ise Jons Jakob Berzelius tarafından izole edilmiştir.
İnorganik kimya veya anorganik kimya; organik olmayan, yani karbon-hidrojen bağı içermeyen bileşiklerin özelliklerini ve kimyasal davranışlarını inceleyen kimya dalı. Anorganik ve organik kimyayı birleştiren organometalik bileşikler, organometalik kimya adında başka bir dalı oluşturur.

Organik kimya, organik bileşiklerin ve organik maddelerin yani karbon atomlarını içeren çeşitli formlardaki maddelerin yapısını, özelliklerini ve reaksiyonların bilimsel çalışmasını içeren, kimyanın bir alt dalıdır. Yapının incelenmesi yapısal formüllerini belirler. Özelliklerin incelenmesi, fiziksel ve kimyasal özellikleri ve davranışlarını anlamak için kimyasal reaktivitenin değerlendirilmesidir. Organik reaksiyonların incelenmesi doğal ürünlerin, ilaçların ve polimerlerin kimyasal sentezini ve bireysel organik moleküllerin laboratuvarda ve teorik çalışma yoluyla incelenmesidir.

Organik bileşikler, molekülleri karbon içeren kalabalık kimyasal bileşikler sınıfındandır. Aşağıda sunulan tarihsel nedenlerden dolayı, bu bileşiklerin küçük bir kısmı, örneğin karbonatlar, basit karbon oksitleri ve siyanürlerin yanı sıra, karbon allotropları inorganik kabul edilir. "Organik" ve "inorganik" karbon bileşikleri arasındaki ayrım "kimyanın geniş alanını düzenlemek için yararlı olsa da, çoğunlukla rastgeledir".

İnorganik, organik olmayan anlamına gelir. Biyolojide su, mineral, asit, baz, tuzlar gibi canlıların yapısında bulunan ancak canlı olmayan veya bir canlı tarafından üretilmemiş bileşiklerdir. Kimyada inorganik bileşikler, sıklıkla karbon taşımayan moleküllerdir. Bunlara örnek olarak da, anyonlar veya katyonlar olarak sınıflandırılan çeşitli iyonik bileşikler ile kovalent bileşikleri verilebilir. Birçoğu iyonlardan meydana gelmiş olsa da kovalent bağlı inorganik bileşikler de bulunur. Karbon disülfür, karbonmonoksit ve siyanürler gibi karbon bileşikleri inorganik olarak kabul edilir.

Sülfat iyonu, inorganik kimyada bir sülfür atomu ile bunu tetrahedral yapıda çevreleyen dört eş oksijen atomundan oluşan, negatif yüklü bir anyondur. Ampirik formülü SO42- ve moleküler ağırlığı 96,06 daltondur. Hidrojenle birleştiğinde sülfürik asit oluşturur. Ayrıca,Dimetil sülfat gibi organik sülfatlar, kovalent bileşiklerdir ve sülfürik asidin esterleridir.
- Sülfürik asitte metalin eritilmesi
- Sülfürik asidin bir metal hidroksit veya oksit ile reaksiyonu
- Metal sülfür veya sülfitlerin oksidasyonu
Stronsiyum nitrat formülü Sr(NO3)2 olan inorganik bileşiktir. Beyaz kristallere sahip bu bileşik piroteknik bileşimlerde kırmızı renk vermek için kullanılır.
Hafniyum(IV) Oksit HfO2 şeklinde formüle edilen inorganik bir bileşiktir.

Yükseltgen madde bir yükseltgenme-indirgenme (redoks) reaksiyonunda başka bir türden bir elektron alan element ya da bileşiktir. Yükseltgen maddelerin elektron kazandıklarından dolayı indirgendikleri söylenebilir.

Organosilisyum bileşikleri, karbon-silisyum bağı ihtiva eden organik bileşiklerdir. Organosilisyun kimyası bu bileşiklerin özelliklerini ve reaktivitelerini keşfeden bilim dalıdır. Organosilisyum bileşikleri sıradan organik bileşiklere benzer şekilde renksiz, yanıcı, hidrofobik ve stabillerdir. İlk organosilisyum bileşiği olan tetraetilsilan, 1863 yılında Charles Friedel ve James Crafts tarafından dietilçinko ile tetraklorosilan reaksiyonu gerçekleştirilerek keşfedilmiştir. Bir Karbosilisyum olmasına rağmen silisyum karbür bir inorganik bileşiktir.

Potasyum kromat, kimyasal formülü K2CrO4 olan inorganik bir bileşiktir. Bu sarı katı madde, kromat anyonunun potasyum tuzudur. Sodyum kromat endüstriyel öneme sahip iken potasyum kromat daha çok laboratuvarlarda kullanılır. Potasyum kromat, kanserojen sınıfında bir madde olup kategori 2 kapsamında değerlendirilmektedir.

Sodyum bromür, NaBr formülüne sahip inorganik bir bileşiktir. Yüksek erime noktasına sahip beyaz kristal yapısıyla sofra tuzuna benzemektedir. Genellikle bromür iyonu kaynağı olarak çeşitli alanlarda kullanılmaktadır.

Gümüş tetrafloroborat, AgBF4 kimyasal formülüne sahip inorganik bir bileşiktir. Polar organik çözücülerin yanı sıra su içinde çözünen beyaz bir katıdır. Katı halde, Ag + merkezleri florüre bağlanır.

Arsenöz asit (veya arsenik oksit), H3AsO3 formülüne sahip bir inorganik bileşiktir. Sulu çözeltilerde meydana geldiği bilinmektedir, ancak bu gerçek As(OH)3'ün öneminden uzaklaşmasa da saf bir malzeme olarak izole edilmemiştir.
Perbromik asit, HBrO4 formülüne sahip bir inorganik bileşiktir. Bir brom oksoasitidir. Perbromik asit kararsızdır ve periyodik asit hazırlandıkça klorun perklorik asitten yer değiştirmesi ile oluşturulamaz; sadece perbromat iyonunun protonlanması ile yapılabilir.
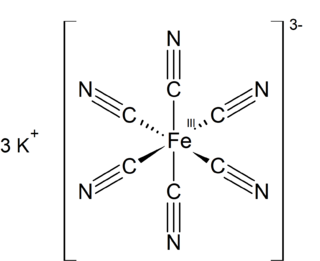
Potasyum ferrisiyanür K3[Fe(CN)6] formülü ile gösterilen inorganik bileşiktir. Bu parlak kırmızı tuz, oktahedral olarak koordine edilmiş [Fe(CN)6]3− iyonu içerir. Suda çözünür ve çözeltisi bir miktar yeşil-sarı flüoresans gösterir. 1822 yılında Leopold Gmelin tarafından keşfedilmiştir ve başlangıçta ultramarin boyalarının üretiminde kullanılmıştır.
Eksplosoforlar organik kimyada organik bileşiklere patlayıcı özellikler kazandıran fonksiyonel gruplardır.

Kofaktör, bir enzimin bir katalizör olarak aktivitesi için gerekli olan, bir kimyasal reaksiyonun hızını artıran, protein olmayan bir kimyasal bileşik veya metalik iyondur. Kofaktörler, biyokimyasal dönüşümlere yardımcı olan "yardımcı moleküller" olarak düşünülebilir. Kofaktörler tipik olarak, işlevlerini enzimlere bağlı kalarak yerine getirmeleri açısından ligandlardan farklılık gösterir.













