Glikozilasyon
Glikozilasyon enzimler aracılığıyla sakkaritlerin birbirine bağlanarak proteinlere, lipitlere veya organik moleküllere bağlı glikanlar oluşturma sürecidir. Glikozilasyon çevrimle eş zamanlı ve çevrim sonrası bir değişim sürecidir. Glikanlar membran proteinlerinde ve salgılanan proteinlerde çeşitli yapısal ve işlevsel rollere sahiptir.[1] Endoplazmik retikulumda sentezlenen proteinlerin çoğunluğu glikozilasyona uğrar. Bu süreç enzim güdümlü ve konuma özgündür, bu bakımdan enzimsiz yürüyen bir kimyasal tepkime olan glikasyondan farklıdır. Glikozilasyon ayrıca O-GlcNAc değişimi olarak sitoplazma ve çekirdekte de gerçekleşebilir. Altı sınıf glikan üretilir: 1) asparajin kalıntılarının amid azotuna bağlanan N-bağlı glikanlar, 2) serin ve treonin kalıntılarının hidroksil oksijenine bağlanan O-bağlı glikanlar, 3) serin kalıntılarının hidroksil oksijenine bağlanan glikosilaminoglikanlar, 4) glikanların seramid'e bağlı olduğu glikolipitler, 5) ne protein ve ne lipide bağlı olan hiyaluronan ve 6) glikan bağları aracılığıyla proteinleri lipitlere bağlayan GPI çapaları (İng. GPI anchor).
İşlev
Hedef proteinlere bağlı olan polisakkarit zincirler çeşitli işlevlere sahiptir.[2] Örneğin, bazı proteinler önce glikozile olmazlarsa doğru katlanmazlar.[1] Ayrıca, asparajinlerin amit azotuna bağlı olan polisakkaritler bazı salgılanan proteinleri daha kararlı kılar. Bu durumlarda glikozilasyon doğru katlanma için şart değildir ama glikozile olmayan proteinler hızla yıkıma uğrar. Glikozilasyon hücrelerin birbirine yapışmasında da rol oynar.
Mekanizma
Glikozilasyon için çeşitli mekanizmalar vardır, ama çoğu birkaç ortak özelliğe sahiptir:[1]
- Glikozilasyon, glikasyondan farklı olarak, enzimatik bir süreçtir.
- Verici molekül genelde etkinleşmiş bir nükleotit şekerdir.
- Süreç, modifikasyona uğrayacak konum için özgündür.
N-bağlı glikozilasyon
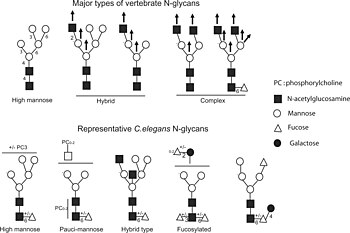
N-bağlı glikozilasyon ökaryotik proteinlerin katlanmasında önemlidir. Bu süreç ökaryotlarda ve çoğu arkede görülür ama bakterilerde çok enderdir.
N-bağlı oligosakkaritlerde, hedef proteindeki asparajine önce 14 şekerli bir öncül (prekürsör) eklenir. Bu öncülün yapısı çoğu ökaryotta aynıdır, 3 glukoz, 9 mannoz ve 2 N-asetilglukozamin molekülü içerir. Karmaşık bir tepkimeler dizisi ile bu dallı zincir dolikol adı verilen bir taşıyıcı moleküle eklenir ve sonra hedef protein ER lümenine geçerken polipeptit üzerindeki uygun yere aktarılır.
N-bağlı sakkaritlerin üç ana tipi vardır: çok mannozlu oligosakkaritler, karmaşık oligosakkaritler ve hibrit oligosakkaritler.[2]
- Çok mannozluda, sadece iki N asetilglukozamin ve çok sayıda mannoz kalıntısı vardır. Mannoz sayısı, proteine bağlanmadan önce prekürsör oligosakkaritteki sayıya yakındır.
- Karmaşık oligosakkaritlerin böyle adlandırılmalarının nedeni, başka tip sakkaritlerden neredeyse herhangi bir sayıda bulundurabilirler, bu sakkaritler arasında orijinal iki N-asetilglukozaminden de daha fazlası olabilir.
Proteinler, farklı bölgelerinde her iki tip oligosakkaritler ile glikozile olabilirler. Bir oligosakkaritin çok mannozlu mu karmaşık mı olduğu, onun Golgi aygıtında sakkarit değişimi yapan enzimlere olan erişilirliğine bağlı olduğu düşünülmektedir. Eğer sakkarit göreli az erişilir durumdaysa, büyük olasılıkla orojinal çok mannozlu seklinde kalacaktır. Eğer erişilebilir durumdaysa, muhtemelen mannoz kalıntılarının pek çoğu kesilip çıkartılacak ve sakkarit yukarıda belirtilen başka şeker grupları eklenecek şekilde başka değişimlere uğrayacaktır.
Oligosakkaritin bağlandığı asparajin kalıntısı, Asn-X-Ser veya Asn-X-Thr dizisi içinde yer alır, burada X Pro hariç herhangi bir amino asittir. Bu bağlanma bir oligosakkariltransferaz enzimi tarafından gerçekleştirilir. Bağlanmanın ardından, protein doğru olarak katlandıktan sonra, zincirden üç glukoz kalıntısı çıkartılır ve protein ER'den ihraç edilmeye hazır hale gelir. Meydana gelen glikoprotein sonra Golgi aygıtına taşınır, orada bazı mannoz kalıntılarının da çıkartılması mümkündür. Ancak, proteinin doğru taşınması için glikozilasyon gerekli değildir. Glikozilasyonun belli adımlarını engelleyen ilaçlarla veya belli bir glikozilasyon enziminden mahrum mutantlarla yapılan deneyler göstermiştir ki, diğer bakımlardan normal proteinler gene de üretilip hücre içinde doğru mekanlara taşınırlar, bu müdahale hücrenin sağlığını önemli derecede etkilemez. Olgun glikoproteinler çeşitli oligomannozlu N-bağlı oligosakkarit içerebilir, bunlar 5-9 adet mannoz kalıntısı içerebilir. Mannoz kalıntılarının geri kalanının da çıkartılması ile 3 mannoz ve iki N-asetilglukozamin kalıntısı içeren bir 'çekirdek' yapıya ulaşılır. Bu yapı sonradan çeşitli monosakkaritler (galaktoz, N-asetilglukozamin, N-asetilgalaktozamin, fukoz ve sialik asit gibi) eklenerek uzatılır.
O-bağlı glikozilasyon
O-N-asetilgalactozamin (O-GalNAc)
O-bağlı glikozilasyon protein işlenmesinin daha ileri bir aşamasında, muhtemelen Golgi aygıtı içinde olur. Bu süreç, serin veya treonin kalıntılarına UDP-N-asetil-D-galactozamin:polipeptit N-asetilgalaktozaminiltransferaz (EC 2.4.1.41) enzimi tarafından N-asetil-galaktozamin eklenmesi, ardından da başka karbonhidratların (galaktoz ve sialik asit gibi) eklenmesidir. Bu süreç proteoglikan gibi bazı protein tipleri için önemlidir; başlagıçta glikozilasyonu olmayan proteoglikan çekirdek proteinlere (proteoglycan core proteins) glikozaminoglikan zincirleri eklenir. Bu proteinler serin O-bağlı glikoproteinlerdir ve iki ik ana işlevleri vardır. Bir işlev, hücredışı matriksin bileşenlerini oluşturmak için salgılanmadır, böylece hücreler arasındaki büyük proteoglikan kompleksler aracılığıyla bir hücre bir diğerine bağlanır. Öbür önemli işlev, mukoza salgılarının bir bileşimi olup mukusun "sümüksü" özelliğine verir. Kanda bulunan proteinler genelde O-glikozile değildir, bunun istisnası IgA1 ve IgD (iki antikor tipi) ve C1 inhibitörüdür.
O fukoz
O-fukoz, GDP-fucoz protein O-fukoziltransferaz 1 ve 2 tarafından eklenir. Bu iki enzimden birincisi EGF-benzeri tekrar dizileri içeren proteinlere (Notch proteini gibi), ikincisi ise Trombospondin tekrar dizilerini glikozile eder. EGF-benzeri tekrarlı dizilerde O-fukoz'a sırayla N-asetilglukosamin (GlcNAc), galactoz, and sialik asit eklenerek bir tetrasakkarit oluşturulur. Trombospondin tekrar dizilerinde ise bir glukoz eklenmesi ile bir disakkarit oluşturulur. Diğer glikoziltransferazların çoğu Golgi aygıtı'nda işlev verirken bu fukoziltransferazların ikisinin de endoplazmik retikulumda yer alırlar.
O-glukoz
O-glukoz, Notch proteininin EGF-benzeri tekrarlı dizilerde birinci ve ikinci korunmuş sisteinler arasına, ayrıca muhtemelen henüz tespit edilmemiş bir O-glukoziltransferazın diğer substratlarına eklenir.
O-N-asetilglukozamin (O-GlcNAc)
O-GlcNAc, O-GlcNAc transferaz tarafından serin ve treoninlere eklenir. Bu serin veya treoninlere O-GlcNAc eklenmezse normalde serin/treonin kinazlar tarafından fosforile olurlar. Yani, eğer fosforilasyon olursa O-GlcNAc eklenmez, O-GlcNAc eklenirse forforilasyon olmaz. Fosforilasyon/defosforilasyon hücrelerde sinyalizasyonun düzenlenmesinde çok önemli bir rol oynamakatadır, glikozilasyonun da bununla ilişkili olması konuya ayrı bir boyut getirir. O-GlcNAc eklenmesi ve çıkarılması, diyabet mellitusta etkinleşen yolakların düzenlenmesinde rol oynamaktadır. O-GlcNAc çıkarıcı enzimi kodlayan gen, insülinden bağımsız diyabet mellitus ile ilişkilendirilmiştir. Bu enzim besin algılayıcı heksozamin sinyalizasyon yolağının son adımında yer alır.
O-mannoz
O-mannozilasyon sırasında mannoz-p-dolikol'daki mannoz, salgı yolağında proteinlerin serin/treonin kalıntılarına eklenir.<[3] O-mannozilasyon hem prokaryot hem ökaryotlarda görülür.
GPI çapa
Özel bir glikozilasyon şekli GPI çapası olarak adlandırılır (İng. GPI anchor). Bu glikozilasyonun tipinin işlevi, bir proteini, bir glikan zincir aracılığyla hidrofobik bir lipid çapaya bağlamaktır (ayrıca bkz. prenilasyon).
C-mannozilasyon
Trombospondin tekrarlarında triptofan kalıntılarına bir mannoz kalıntısı eklenir. Bu ender görülen bir değişimdir, hem şekerin reaktif bir azot veya oksijen atomu yerine bir karbon atomuna bağlanmış olması bakımından, hem de şekerin asparajin, serin veya treonin değil de bir triptofan kalıntısına bağlanmış olması bakımından.
Ayrıca bakınız
- Gliko-rassallaşma
- İlerlemiş glikasyon sonürünleri
- Kimyasal glikozilasyon
- Fukozilasyon
Dış bağlantılar
- Glikobiyoloji ders kitabının glikozilasyonla ilgili bölümleri5 Mart 2009 tarihinde Wayback Machine sitesinde arşivlendi. (İngilizce)
- GlyProt: Proteinlerin sanal N-glikozilasyonu[] (İngilizce)
- NetNGlyc6 Mart 2010 tarihinde Wayback Machine sitesinde arşivlendi.: NetNglyc sunucusu insan proteinlerinde N-glikozilasyon konumlarının konumlarını tahmin etmek için Asn-Xaa-Ser/Thr dizilerinin içinde bulunduğu bağlamı inceleyen yapay nöral ağları kullanır
Kaynakça
- ^ a b c Ajit Varki (ed.) (2009). Essentials of Glycobiology (2. bas.). Cold Spring Harbor Laboratories Press. ISBN 978-087969770-9.
- ^ a b Drickamer, K (2006). Introduction to Glycobiology (2. bas.). Oxford University Press, USA. ISBN 978-0199282784.
- ^ Lommel M, Strahl S (2009). "Protein O-mannosylation: conserved from bacteria to humans". Glycobiology. 19 (8). ss. 816-28. doi:10.1093/glycob/cwp066. PMID 19429925.