Germanyum
Germanyum (Ge) | |
| Temel özellikleri | |
|---|---|
| Atom numarası | 32 |
| Element serisi | Metaloidler |
| Grup, periyot, blok | 14, 4, p |
| Görünüş | Gümüş grisi  |
| Kütle numarası | 72.59 g/mol |
| Elektron dizilimi | [Ar] 3d10 4s2 4p2 |
| Enerji seviyesi başına Elektronlar | 2, 8, 18, 4 |
| CAS kayıt numarası | {{{CAS_kayıt_numarası}}} |
| Fiziksel Özellikleri | |
| Maddenin hâli | Katı |
| Yoğunluk | 5.323 g/cm³ |
| Sıvı hâldeki yoğunluğu | 5.60 g/cm³ |
| Ergime noktası | 1211.40 °K 938.25 °C |
| Kaynama noktası | 3106 °K 2833 °C |
| Ergime ısısı | 36.94 kJ/mol |
| Buharlaşma ısısı | 334 kJ/mol |
| Isı kapasitesi | 23.222 J/(mol·K) |
| Atom özellikleri | |
| Kristal yapısı | Elmas yapı |
| Yükseltgenme seviyeleri | |
| Elektronegatifliği | Pauling ölçeği |
| İyonlaşma enerjisi | 762 kJ/mol |
| Atom yarıçapı | 125 pm |
| Atom yarıçapı (hes.) | 125 pm |
| Kovalent yarıçapı | 122 pm |
| Van der Waals yarıçapı | pm |
| Diğer özellikleri | |
| Elektrik direnci | nΩ·m (20°C'de) |
| Isıl iletkenlik | 60.2 W/(m·K) |
| Isıl genleşme | 6.0 µm/(m·K) (25°C'de) |
| Ses hızı | 5400 m/s ('de) |
| Mohs sertliği | 6.0 |
| Vickers sertliği | MPa |
| Brinell sertliği | MPa |
Germanyum; sembolü Ge, atom numarası 32 olan kimyasal elementtir. Parlak, sert-kırılgan, grimsi-beyaz ve silikona benzer bir görünümdedir. Silisyum ve kalay komşu grubuna kimyasal olarak benzeyen karbon grubundaki bir metaloiddir. Silikon gibi, germanyum da doğal olarak reaksiyona girer ve doğadaki oksijenle kompleksler oluşturur.
Germanyum yüksek konsantrasyonda nadiren göründüğü için geç keşfedildi. Germanyum, yer kabuğundaki elementlerin göreceli bolluğunda elliye yakın bir yerdedir. 1869'da Dmitri Mendeleev, varlığı ve bazı özelliklerini periyodik tablodaki konumundan tahmin etti ve elementi ekasilicon olarak isimlendirdi. 1886'da Freiberg Üniversitesi'nden Clemens Winkler, argyrodite mineralinde gümüş ve kükürtle birlikte yeni elementi buldu ve elemente ülkesi Almanya'nın adını verdi. Germanyum esas olarak sfaleritten (çinkonun birincil cevheri) çıkarılır, ancak germanyum ticari olarak gümüş, kurşun ve bakır cevherlerinden de geri kazanılır.
Elemental germanyum, transistör ve çeşitli elektronik cihazlarda yarı iletken olarak kullanılır. Tarihsel olarak, yarı iletken elektroniğin ilk on yılı tamamen germanyuma dayanıyordu. Şu anda başlıca kullanımlar, fiber optik, kızılötesi optikler, güneş hücresi uygulamaları ve ışık yayan diyotlar (LED)dır. Germanyum bileşikleri polimerizasyon katalisti olarak kullanılır ve son zamanlarda nanotel üretiminde kullanım alanı bulmuştur. Bu element, organometalik kimyada yararlı olan tetraetilgermanyum gibi çok sayıda organogermanyum bileşiği oluşturur. Germanyum, teknoloji açısından kritik bir element olarak kabul edilir.[1]
Germanyumun canlılık için gerekli bir element olduğu düşünülmemektedir.Doğal olarak oluşan germanyum bileşikleri suda çözünmez olma eğilimindedir ve bu nedenle çok az oral toksisiteye sahiptir. Bununla birlikte, sentetik çözünür germanyum tuzları nefrotoksiktir ve halojenler ve hidrojen içeren sentetik kimyasal olarak reaktif germanyum bileşikleri tahriş edici toksinlerdir.
Tarih

Rus kimyacı Dmitri Mendeleev, 1869'da Kimyasal Elementlerin Periyodik Yasası hakkındaki raporunda, silisyum ve kalay arasında karbon ailesindeki bir boşluğu dolduracak olan bir kimyasal elementin varlığını tahmin etti.[2] Periyodik tablosundaki konumu nedeniyle Mendeleev buna ekasilicon (Es) adını verdi ve atom ağırlığını 70 (daha sonra 72) olarak tahmin etti.
1885'in ortalarında, Saksonya, Freiberg yakınlarındaki bir madende yeni bir mineral keşfedildi ve yüksek gümüş içeriği nedeniyle argyrodite olarak adlandırıldı. Kimyager Clemens Winkler, gümüş, kükürt ve yeni bir elementin birleşimi olduğu kanıtlanan bu yeni minerali analiz etti. Winkler, 1886'da yeni elementi izole edebildi ve onu antimona benzer buldu. Başlangıçta yeni elementin eka-antimon olduğunu düşündü, ancak kısa süre sonra onun bunun yerine eka-silikon olduğuna ikna oldu.[3][4] Winkler, yeni elementle ilgili sonuçlarını yayınlamadan önce, elementine neptünyum adını vermeye karar verdi, çünkü 1846'da Neptün gezegeninin keşfi de benzer şekilde onun varlığına dair önceki matematiksel tahminlerin ardından gelmişti. Bununla birlikte, "neptunium" adı, tahmin edilen başka bir kimyasal elemente zaten verilmişti (bugün 1940'ta keşfedilen neptunium adını taşıyan element değil). Bunun yerine Winkler, anavatanının onuruna yeni elemente germanyum (Latince Germania kelimesinden) adını verdi.[4] Argyrodite ampirik olarak Ag8GeS6 olduğunu kanıtladı. Bu yeni element, arsenik ve antimon elementleriyle bazı benzerlikler gösterdiğinden, periyodik tablodaki uygun yeri düşünülüyordu, ancak Dmitri Mendeleev'in tahmin ettiği element "ekasilicon" ile benzerlikleri periyodik tablodaki yerini doğruladı.[4][5] Saksonya'daki madenlerden çıkarılan 500'kg'dan fazla malzeme ile Winkler 1887'de yeni elementin kimyasal özelliklerini doğruladı.[3][4][6] Ayrıca saf germanyum tetraklorürü (GeCl4 analiz ederek 72.32'lik bir atom ağırlığı belirledi. Lecoq de Boisbaudran ise elementin kıvılcım spektrumundaki çizgileri karşılaştırarak 72.3'ü elde etti.[7]
Winkler, flor, klor, sülfür, dioksit bileşikleriyle ilk organogerman olan tetraetilgerman (Ge(C2H54) dahil olmak üzere birkaç germanyum bileşiği hazırlayabildi.[3] Mendeleev'in tahminleriyle iyi bir şekilde örtüşen bu bileşiklerden elde edilen fiziksel veriler, keşfi Mendeleyev'in element periyodikliği fikrinin önemli bir teyidi haline getirdi.[3]
Germanyumun 1930'ların sonlarına kadar zayıf iletken bir metal olduğu düşünülüyordu.[8] Germanyum, elektronik yarı iletken olarak özelliklerinin kabul edildiği 1945 sonrasına kadar ekonomik olarak önemli hale gelmedi. İkinci Dünya Savaşı sırasında, çoğu diyot olmak üzere bazı özel elektronik cihazlarda az miktarda germanyum kullanıldı.[9][10] İlk büyük kullanım, Savaş sırasında radar dalga tespiti için nokta temaslı Schottky diyotlarıydı.[8] İlk silikon-germanyum alaşımları 1955'te elde edildi.[11] 1945'ten önce izabe tesislerinde her yıl yalnızca birkaç yüz kilogram germanyum üretiliyordu, ancak 1950'lerin sonunda dünya çapındaki yıllık üretim 40 metrik tona ulaştı.[12]
1948'de germanyum transistörün geliştirilmesi[13] sayısız katı hal elektroniğine kapı açtı.[14] 1950'den 1970'lerin başına kadar, bu alan germanyum için artan bir pazar sağladı, ancak daha sonra transistör, diyot ve doğrultucularda germanyumun yerini yüksek saflıkta silikon almaya başladı.[15] Örneğin, Fairchild Semiconductor olan şirket, 1957'de açık bir şekilde silikon transistörler üretmek amacıyla kuruldu. Silikon üstün elektriksel özelliklere sahiptir, ancak yarı iletken elektroniğin ilk yıllarında ticari olarak elde edilemeyen çok daha fazla saflık gerektirir.[16]
Bu arada, fiber optik iletişim ağları, gece görüş sistemleri ve polimerizasyon katalizörleri için germanyuma olan talep önemli ölçüde arttı.[12] Bu son kullanımlar, 2000 yılında dünya çapındaki germanyum tüketiminin %85'ini temsil ediyordu.[15] ABD hükûmeti, germanyumu stratejik ve kritik bir malzeme olarak belirledi ve stokladı.[12]
Germanyum arzı kullanılabilir kaynakların mevcudiyeti ile sınırlı olması bakımından silikondan farklıdır.Silikon sıradan kum ve kuvarstan geldiğinden, yalnızca üretim kapasitesi ile sınırlıdır. Silisyum 1998'de kg başına 10 dolardan daha ucuza satın alınabilirken, germanyumun fiyatı kg başına neredeyse 800 dolardı.[12]
Özellikler
Standart koşullar altında, germanyum kırılgan, gümüşi beyaz, yarı metalik bir elementtir.[17] Bu form, a-germanium olarak bilinen, metalik bir parlaklığa ve elmasla aynı elmas kübik kristal yapıya sahip bir allotrop oluşturur.[15] Kristal formda iken, germanyum yer değiştirme eşik enerjisine sahiptir. .[18] 120 kbar'ın üzerindeki basınçlarda, germanyum, β- kalay ile aynı yapıya sahip allotrop β-germanyum haline gelir.[19] Silisyum, galyum, bizmut, antimon ve su gibi, germanyum da erimiş halde katılaştıkça (yani donarken) genleşen az sayıdaki maddeden biridir.[19]
Germanyum, kristal silisyum gibi dolaylı bir bant aralığına sahip bir yarı iletkendir. Bölge arıtma teknikleri, yarı iletkenler için 1010' yalnızca bir parça safsızlığa sahip kristal germanyum üretimine yol açmıştır,[20] bu onu şimdiye kadar elde edilen en saf malzemelerden biri yapmaktadır.[21] Son derece güçlü bir elektromanyetik alanın varlığında süper iletken olduğu keşfedilen (2005'te) ilk metalik malzeme, germanyum, uranyum ve rodyum alaşımıydı.[22]
Saf germanyumun, germanyum bıyıkları olarak anılan çok uzun vida dislokasyonlarını kendiliğinden ekstrüde ettiği bilinmektedir. Bu bıyıkların büyümesi, germanyumdan yapılan eski diyotlar ve transistörlerin arızalanmasının birincil nedenlerinden biridir, çünkü sonunda kısa devre yapabilirler.[23]
Kimya
Elemental germanyum yaklaşık 250 °C de havada yavaşça oksitlenmeye başlayarak GeO<sub id="mwAT8">2</sub> oluşturuyor.[24] Germanyum seyreltik asitler ve alkalilerde çözünmez, ancak sıcak konsantre sülfürik ve nitrik asitlerde yavaşça çözünür ve erimiş alkalilerle şiddetli reaksiyona girerek germanatlar üretir ([GeO3]2-). Germanyumun birçok +2 bileşiği bilinmesine rağmen çoğunlukla +4 oksidasyon durumunda oluşur. Diğer oksidasyon durumları nadirdir: Ge2Cl6 gibi bileşiklerde +3, oksitlerin yüzeyinde +3 ve +1 bulunur,[25] veya germanitlerde negatif oksidasyon durumları bulunabilir; örneğin Mg2Ge -4 de olduğu gibi.
Ge42−, Ge94−, Ge92−, [(Ge9)2]6− gibi Germanyum küme anyonları (Zintl iyonları), sıvı amonyak içinde alkali metaller ve germanyum içeren alaşımlardanetilendiamin veya bir kriptandın varlığında ekstraksiyon yoluyla hazırlanmıştır.[26][27]
İki germanyum oksidi bilinmektedir: germanyum dioksit (GeO2) ve germanyum monoksit, (GeO).[19] Dioksit, GeO2, germanyum disülfidin (GeS2) kavrulmasıyla elde edilebilir ve suda çok az çözünen, ancak germanatlar oluşturmak için alkalilerle reaksiyona giren beyaz bir tozdur.[19] Monoksit, GeO 2'nin Ge metali ile yüksek sıcaklıkta reaksiyonuyla elde edilebilir.[19] Dioksit (ve ilgili oksitler ve germanatlar), görünür ışık için yüksek bir kırılma indeksine sahip olma, ancak kızılötesi ışığa karşı şeffaflık gibi alışılmadık bir özellik sergiler.[28][29] Sintilatör olarak Bismut germanate, Bi4 Ge3O12 kullanılmaktadır.[30]
Diğer kalkojenlerle Di sülfit (GeS2) gibi ikili bileşikler de bilinmektedir; GeS2 ve di selenid (GeSe2) ve monosülfit (GeS), monoselenit (GeSe) ve mono tellür (GeTe). GeS2, hidrojen sülfür Ge(IV) içeren güçlü asit çözeltilerinden geçirildiğinde beyaz bir çökelti olarak oluşur.[26] Disülfit, suda ve kostik alkali veya alkalin sülfitlerin çözeltilerinde önemli ölçüde çözünür. Bununla birlikte, Winkler'in elementi keşfetmesine izin veren asidik suda çözünmez.[31] Disülfitin bir hidrojen akımında ısıtılmasıyla, koyu renkli ve metalik parlaklığa sahip ince plakalarda süblimleşen ve kostik alkalilerin çözeltilerinde çözünen monosülfür (GeS) oluşur.[19] Alkalin karbonatlar ve kükürt ile eritildiğinde, germanyum bileşikleri, tiyogermanatlar olarak bilinen tuzları oluşturur.[32]
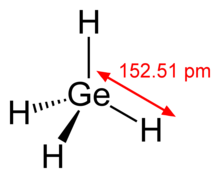
Dört tetra halojenür bilinmektedir. Normal şartlar altında GeI4 katı, GeF4 gaz ve diğerleri uçucu sıvılardır. Örneğin, germanyum tetraklorür, 83.1'°Cde metali klor ile ısıtarak kaynayan renksiz, dumanlı bir sıvı olarak elde edilir.[19] Tüm tetrahalidler kolayca hidratlı germanyum dioksite hidrolize edilir.[19] GeCl4 organogermanyum bileşiklerinin üretiminde kullanılır. Dört dihalidin tümü bilinmektedir ve tetrahalidlerin aksine polimerik katılardır.[26] Ek olarak Ge2Cl6 ve GenCl2n+2 formülünün bazı daha yüksek bileşikleri bilinmektedir.[19] Neopentan yapıya sahip Ge5Cl12 birimini içeren sıra dışı bileşik Ge6Cl16 hazırlanmıştır.[33]
Germane (GeH4), yapı olarak metana benzer bir bileşiktir. Beşe kadar germanyum atomu içeren GenH2 n+2 formülüne sahip alkanlara benzer bileşikler olan poligermanlar bilinmektedir. GeH4 sıvı amonyak içinde alkali metallerle reaksiyona girerek GeH<sub id="mwAck">3</sub><sup id="mwAco">-</sup> anyonu içeren beyaz kristal MGeH3 oluşturur.[26] Bir, iki ve üç halojen atomlu germanyum hidrohalojenürler renksiz reaktif sıvılardır.[26]

İlk organogermanyum bileşiği, 1887'de Winkler tarafından sentezlendi; germanyum tetraklorürün dietilçinko ile reaksiyonu tetraetilgerman verdi (Ge(C2H5)4.[3] Tetrametilgerman gibi R4Ge (burada R bir alkildir) tipindeki organogermanlar Ge(CH3)4 ve tetraetilgermana mevcut en ucuz germanyum öncüsü germanyum tetraklorür ve alkil nükleofiller yoluyla erişilir. İzobütilgerman (CH3)2CHCH2GeH3 gibi organik germanyum hidritlerin daha az tehlikeli yarı iletken uygulamalarında zehirli German gazı yerine kullanılabileceği bulunmuştur. Birçok germanyum reaktif ara ürünü bilinmektedir: germil serbest radikalleri, germilenler (karbenlere benzer) ve germynes (karbinlere benzer).[34][35] Organogermanyum bileşiği 2-karboksietilgermaseskuioksan ilk olarak 1970'lerde rapor edildi ve bir süre besin takviyesi olarak kullanıldı ve muhtemelen anti-tümör niteliklere sahip olduğu düşünülüyordu.[36]
Germanyum Eind adlı bir ligand (1,1,3,3,5,5,7,7-oktaetil-s-hidrindasen-4-il) kullanarak oksijenle çift bağ (germanon) oluşturabilir. Germanyum hidrit ve germanyum tetrahidrit hava ile karıştırıldığında çok yanıcı ve hatta patlayıcıdır.[37]
İzotoplar
Germanyum 5 doğal izotopta bulunur: 70Ge, 72Ge, 73Ge, 74Ge ve 76Ge. Bunlardan 76Ge çok az radyoaktiftir, yarı ömrü 1.78×1021 yıl olan çift beta bozunmasıyla bozunur. 74Ge yaklaşık %36 doğal bolluğa sahip en yaygın izotoptur. 76Ge yaklaşık %7 doğal bolluk ile en az yaygın olanıdır. 72Ge,
Alfa parçacıkları ile bombardıman edildiğinde, istikrarlı 77Se üretir ve süreçte yüksek enerjili elektronlar serbest bırakır.[38] Bu nedenle nükleer piller için radon ile birlikte kullanılır.[38]
Atom kütlesi 58 ila 89 arasında değişen en az 27 radyoizotop da sentezlendi. Bunlardan en kararlı olanı 68Ge, 270,95 gün yarı ömürlü, elektron yakalama ile bozunur. En az kararlıyarı ömrü 30ms olan 60Ge'tır. Germanyumun radyoizotoplarının çoğu beta bozunmasıyla bozunurken 61Ge ve 64Ge gecikmiş
β+
bozunur. 84Ge den 87Ge'ye izotoplar ayrıca minör
β-
gecikmeli nötron emisyon bozunma yolları sergiler.[39]
Varlığı

Germanyum, yıldız nükleosentezi tarafından, çoğunlukla asimptotik dev dal yıldızlarında s-işlemi tarafından oluşturulur. S süreci, titreşen kırmızı dev yıldızların içindeki daha hafif elementlerin yavaş bir nötron yakalamasıdır.[40] Germanyum en uzak yıldızların bazılarıyla[41] Jüpiter'in atmosferinde tespit edilmiştir.[42]
Germanyumun yer kabuğundaki bolluğu yaklaşık olarak 1.6'ppmdir.[43] Arjirodit, briartit, germanit, renierit ve sfalerit gibi sadece birkaç mineral önemli miktarda germanyum içerir.[15][44] Sadece çok azı (özellikle germanit) çok nadiren kazılabilir miktarlarda bulunur.[45][46][47] Bazı çinko-bakır-kurşun cevher gövdeleri, nihai cevher konsantresinden ekstraksiyonu haklı çıkarmaya yetecek kadar germanyum içerir.[43] Alışılmadık bir doğal zenginleştirme işlemi, Victor Moritz Goldschmidt tarafından germanyum yatakları için yapılan geniş bir araştırma sırasında keşfedilen bazı kömür damarlarında yüksek bir germanyum içeriğine neden olur.[48][49] Şimdiye kadar bulunan en yüksek konsantrasyon, %1,6 oranında germanyum içeren Hartley kömür külündeydi.[48][49] İç Moğolistan, Xilinhaote yakınlarındaki kömür yatakları tahminen 1600 ton germanyum barındırıryor.[43]
Üretim
2011 yılında dünya çapında, çoğunlukla Çin (80 ton), Rusya (5 ton) ve Amerika Birleşik Devletleri'nde (3 ton)olmak üzere yaklaşık 118 ton germanyum üretildi.[15] Germanyum, %0,3'e varan oranlarda yoğunlaştığı sfalerit çinko cevherlerinden,[50] özellikle düşük sıcaklıkta tortu barındıran, masif Zn – Pb – Cu (– Ba ) yatakları ve karbonatlı Zn-Pb depozitlerden bir yan ürün olarak geri kazanılır.[51] Yakın zamanda yapılan bir araştırma, bilinen çinko rezervlerinde, özellikle Mississippi-Valley tipi yataklarda bulunanlarda en az 10.000 ton çıkarılabilir germanyum bulunduğunu, kömür rezervlerinde ise en az 112.000 ton bulunacağını buldu.[52][53] 2007'de talebin %35'i geri dönüştürülmüş germanyumdan karşılandı.[43]
| Yıl | Fiyatı ($ /kg) [54] |
|---|---|
| 1999 | 1.400 |
| 2000 | 1.250 |
| 2001 | 890 |
| 2002 | 620 |
| 2003 | 380 |
| 2004 | 600 |
| 2005 | 660 |
| 2006 | 880 |
| 2007 | 1.240 |
| 2008 | 1.490 |
| 2009 | 950 |
| 2010 | 940 |
| 2011 | 1.625 |
| 2012 | 1.680 |
| 2013 | 1.875 |
| 2014 | 1.900 |
| 2015 | 1.760 |
| 2016 | 950 |
| 2017 | 1.358 |
| 2018 | 1.300 |
| 2019 | 1.240 |
| 2020 | 1.000 |
Ağırlıklı olarak sfaleritten üretilmekle birlikte gümüş, kurşun ve bakır cevherlerinde de bulunur. Germanyumun diğer bir kaynağı da, germanyum içeren kömürlü elektrik santrallerinin uçucu külüdür. Rusya ve Çin bunu germanyum kaynağı olarak kullandı.[55] Rusya'nın yatakları uzakdoğu Sakhalin Adası'nda ve Vladivostok'un kuzeydoğusunda yer almaktadır. Çin'deki yataklar ağırlıklı olarak Lincang, Yunnan yakınlarındaki linyit madenlerinde bulunuyor; İç Moğolistan'daki Xilinhaote yakınlarında da kömür çıkarılıyor.[43]
Cevher konsantreleri çoğunlukla sülfürlüdür; kavurma olarak bilinen bir işlemde havayla ısıtılarak oksitlere dönüştürülürler:
- GeS2 + 3 O2 → GeO2 + 2 SO2
Germanyumun bir kısmı üretilen tozda kalırken, geri kalanı çinko ile birlikte sülfürik asitle cüruftan süzülen germanatlara dönüştürülür. Nötralizasyondan sonra, germanyum ve diğer metaller çökelirken sadece çinko çözeltide kalır. Waelz işlemiyle çökeltideki çinkonun bir kısmı uzaklaştırıldıktan sonra, kalan Waelz oksit ikinci kez süzülür. Dioksit çökelti olarak elde edilir ve klor gazı veya hidroklorik asit ile düşük kaynama noktasına sahip olan ve damıtma yoluyla izole edilebilen germanyum tetraklorüre dönüştürülür:[55]
- GeO2 + 4 HCI → GeCl4 + 2 H2O
- GeO2 + 2 Cl2 → GeCl4 + O2
Germanyum tetraklorür okside (GeO2) hidrolize edilir veya fraksiyonel damıtma ile saflaştırılır ve sonra hidrolize edilir.[55] Son derece saf GeO2 artık germanyum cam üretimi için uygundur. Kızılötesi optikler ve yarı iletken üretimi için uygun germanyum üreterek hidrojenle reaksiyona girerek elemente indirgenir:
- GeO2 + 2 H2 → Ge + 2 H2O
Çelik üretimi ve diğer endüstriyel işlemler için kullanılan germanyum normalde karbon kullanılarak indirgenir:[56]
- GeO2 + C → Ge + CO2
Uygulamalar
2007'de dünya çapında germanyumun ana son kullanımlarının şu şekilde olduğu tahmin ediliyor: %35 fiber optik, %30 kızılötesi optikler, %15 polimerizasyon katalizörleri ve %15 elektronik ve güneş enerjisi uygulamaları.[15] Geri kalan %5 ise fosfor, metalurji ve kemoterapi gibi kullanımlara gitti.[15]
Optik
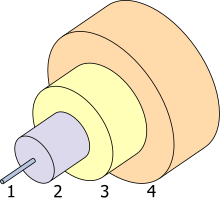
- Core 8 µm
- Cladding 125 µm
- Buffer 250 µm
- Jacket 400 µm
Germanya'nın (GeO2) dikkate değer özellikleri, yüksek kırılma indeksi ve düşük optik dağılımıdır. Bunlar, onu özellikle geniş açılı kamera lensleri, mikroskobi ve optik fiberlerin çekirdek kısmı için kullanışlı kılar.[57][58] Silis elyafı için katkı maddesi olarak titanyanın yerini aldı ve elyafları kırılgan hale getiren müteakip ısıl işlemi ortadan kaldırdı.[59] 2002'nin sonunda fiber optik endüstrisi Amerika Birleşik Devletleri'ndeki yıllık kullanımının %60'ını oluşturmaktaydı, ancak bu dünya çapındaki tüketimin %10'undan daha azdır.[58] GeSbTe, yeniden yazılabilir DVD'lerde kullanılanlar gibi optik özellikleri için kullanılan bir faz değişim malzemesidir.[60]
Germanyum kızılötesi dalga boylarında şeffaf olduğu için önemli bir kızılötesi optik malzemedir. Özellikle 8 'ile 14' mikron aralığında çalışan termal kameralarda ön optik olarak kullanılır. (askeri, mobil gece görüşü ve yangınla mücadele uygulamalarında pasif termal görüntüleme ve sıcak nokta tespiti için)[56] Kızılötesi spektroskoplarda ve son derece hassas kızılötesi dedektörler gerektiren diğer optik ekipmanlarda kullanılır.[58] Çok yüksek bir kırılma indeksine (4.0) sahiptir ve yansıma önleyici maddelerle kaplanmalıdır. Özellikle, elmas benzeri karbonun (DLC) çok sert özel yansıma önleyici kaplaması, kırılma indeksi 2.0, iyi bir eşleşmedir ve çevresel istismarın çoğuna dayanabilen elmas sertliğinde bir yüzey üretir.[61][62]
Elektronik
Germanyum, silikon ile alaşımlanabilir ve silikon-germanyum alaşımları, "yüksek hızlı entegre devreler" için önemli bir yarı iletken malzeme haline geliyor. Si-SiGe heteroeklemlerinin özelliklerini kullanan devreler, tek başına silikon kullananlardan çok daha hızlı olabilir.[63] Yüksek hız özelliklerine sahip olan SiGe çipleri, silikon çip endüstrisinin düşük maliyetli, köklü üretim teknikleri ile yapılabilmektedir.[15]
Yüksek verimli güneş panelleri, germanyumun önemli bir kullanımıdır. Germanyum ve galyum arsenit neredeyse aynı kafes sabitine sahip olduğundan, germanyum substratları galyum-arsenit güneş pilleri yapmak için kullanılabilir.[64] Germanyum, hücrelerinde üçlü bağlantı galyum arsenit kullanan Mars Keşif Gezicileri gibi uzay uygulamaları için yüksek verimli çok bağlantılı fotovoltaik hücreler için kullanıldı.[65] Otomobil farları ve LCD ekranları aydınlatmak için kullanılan yüksek parlaklıktaki LED'ler de önemli bir uygulamadır.[15]
Yalıtkan üzerinde Germanyum (GeOI) substratları, minyatür çiplerde silikon için potansiyel bir ikame olarak görülüyor.[15] GeOI substratlarına dayalı CMOS devresi yakın zamanda rapor edilmiştir.[66] Elektronikteki diğer kullanımlar arasında floresan lambalardaki fosforlar ve katı hal ışık yayan diyotlar (LED'ler) yer alır.[15] Germanyum transistörler, erken rock and roll döneminden "tüylenme" tonunun ayırt edici ton karakterini yeniden üretmek isteyen müzisyenler tarafından bazı efekt pedallarında hala kullanılmaktadır.[67]
Germanyum, vücuda zararlı hidrojen gazı üretmeden emilen implante edilebilir biyoelektronik sensörler için çinko oksit ve indiyum galyum çinko oksit bazlı uygulamaların yerini alan potansiyel bir malzeme olarak incelenmiştir.[68]
Diğer kullanımlar

Germanyum dioksit ayrıca polietilen tereftalat (PET) üretiminde polimerizasyon için kullanılır.[69] Bu polyesterin yüksek parlaklığı özellikle Japonya'da tercih edilmektedir.[69] Amerika Birleşik Devletleri'nde polimerizasyon katalizörleri için kullanılmaz.[15]
Silika (SiO2) ve germanyum dioksit (GeO2) arasındaki benzerlik nedeniyle, bazı gaz kromatografi kolonlarındaki silika durağan fazı GeO2 ile değiştirilebilir.[70]
Son yıllarda germanyum, değerli metal alaşımlarında artan bir kullanım gördü. Örneğin som gümüş alaşımlarında, yangın tortusunu azaltır, kararma direncini artırır ve çökelme sertleşmesini iyileştirir. Argentium ticari markalı, kararmaz bir gümüş alaşımı, %1,2 oranında germanyum içerir.[15]
Tek kristal yüksek saflıkta germanyumdan yapılan yarı iletken dedektörler, havaalanı güvenliğinde radyasyon kaynaklarını kesin olarak tanımlayabilir.[71] Germanyum, tek kristal nötron saçılması ve senkrotron X-ışını kırınımı için kullanılan ışın çizgileri için monokromatörler için kullanışlıdır. Yansıtma, nötron ve yüksek enerjili X-ışını uygulamalarında silikona göre avantajlara sahiptir.[72] Yüksek saflıkta germanyum kristalleri, gama spektroskopisi ve karanlık madde arama dedektörlerinde kullanılır.[73] Germanyum kristalleri ayrıca X-ışını spektrometrelerinde fosfor, klor ve kükürt tayininde kullanılır.[74]
Germanyum, spintronik ve spin tabanlı kuantum hesaplama uygulamaları için önemli bir malzeme olarak ortaya çıkıyor. 2010 yılında, araştırmacılar oda sıcaklığında spin taşınımını [75] gösterdiler ve daha yakın zamanlarda germanyumdaki donör elektron spinlerinin çok uzun tutarlılık sürelerine sahip olduğu gösterildi.[76]
Stratejik önem
Gelişmiş elektronik ve optikte kullanımından dolayı Germanyum, yeşil ve dijital geçişi gerçekleştirmek için gerekli olan (örneğin Avrupa Birliği tarafından) teknoloji açısından kritik bir unsur olarak kabul edilir. Çin, küresel Germanyum üretiminin %60'ını kontrol ettiğinden, dünyanın tedarik zincirleri üzerinde hakim bir konuma sahiptir. 3 Temmuz 2023'te Çin, aniden Germanyum (ve Galyum ) ihracatına kısıtlamalar getirerek Batılı müttefiklerle ticari gerilimleri tırmandırdı. Çin Ticaret Bakanlığı, "ulusal güvenlik çıkarlarına" atıfta bulunarak, Germanyum içeren ürünleri satmayı amaçlayan şirketlerin bir ihracat lisansına ihtiyaç duyacağı konusunda bilgi verdi.[77] Çin bu tür ürünleri, askeri amaçlara sahip olabilen ve bu nedenle fazladan bir gözetim katmanı gerektiren "ikili kullanımlı" ürünler olarak görüyor. Yeni anlaşmazlık, Amerika Birleşik Devletleri'ni ve daha az ölçüde Avrupa'yı Çin'e karşı kışkırtan, giderek daha şiddetli hale gelen teknoloji yarışında yeni bir sayfa açtı. ABD, Pekin'in küresel teknoloji üstünlüğünü güvence altına almasını ve Batı liderliğindeki uluslararası düzene meydan okumasını önlemek için müttefiklerinin Çin pazarına bağlı gelişmiş elektronik bileşenleri ağır bir şekilde dizginlemesini veya tamamen yasaklamasını istiyor. Çin, Germanyum ihracat kısıtlamalarının arkasında herhangi bir kısasa kısas niyetini yalanladı.[78][79][80]
Germanyum ve sağlık
Germanyum bitki veya hayvan sağlığı için gerekli kabul edilmez.[81] Çevredeki germanyumun sağlık üzerinde çok az etkisi vardır veya hiç etkisi yoktur. Bunun başlıca nedeni, genellikle cevherlerde ve karbonlu malzemelerde yalnızca eser element olarak bulunması ve çeşitli endüstriyel ve elektronik uygulamaların yutulması muhtemel olmayan çok küçük miktarları içermesidir.[15] Germanyumunun biyolojik tehlike olarak çevre üzerinde çok az etkisi vardır. Germanyumun bazı reaktif ara bileşikleri zehirlidir.
Hem organik hem de inorganik germanyumdan yapılan germanyum takviyeleri, lösemi ve akciğer kanserini tedavi edebilen alternatif bir ilaç olarak pazarlanmıştır.[12] Bununla birlikte, hiçbir tıbbi fayda kanıtı yoktur; bazı kanıtlar, bu tür takviyelerin zararlı olduğunu göstermektedir.[81] ABD Gıda ve İlaç İdaresi araştırması, inorganik germanyumun besin takviyesi olarak kullanıldığında "potansiyel insan sağlığı tehlikesi arz ettiği" sonucuna varmıştır.[36]
Bazı germanyum bileşikleri, alternatif tıp pratisyenleri tarafından FDA'nın izin vermediği enjekte edilebilir solüsyonlar olarak uygulanmıştır. Başta sitrat-laktat tuzu olmak üzere ilk başta kullanılan çözünür inorganik germanyum formları, bunları uzun süre kullanan kişilerde bazı böbrek fonksiyon bozukluğu, hepatik steatoz ve periferik nöropati vakalarıyla sonuçlandı. Birçoğu ölmüş olan bu bireylerdeki plazma ve idrar germanyum konsantrasyonları, endojen seviyelerden birkaç kat daha yüksekti. Daha yeni bir organik form olan beta-karboksietilgermanyum seskioksit (propagermanium), aynı toksik etki spektrumunu sergilememiştir.[82]
Germanyumun bazı bileşiklerinin memeliler için düşük toksisitesi vardır, ancak belirli bakterilere karşı toksik etkileri vardır.[17]
Kimyasal olarak reaktif germanyum bileşikleri için önlemler
Germanyumun kullanımı önlem gerektirmezken, germanyumun yapay olarak üretilen bazı bileşikleri oldukça reaktiftir ve maruz kalındığında insan sağlığı için ani bir tehlike arz eder. Örneğin, germanyum klorür ve german (GeH4) sırasıyla gözleri, cildi, akciğerleri ve boğazı çok tahriş edebilen bir sıvı ve gazdır.[83]
Kaynakça
- ^ Avarmaa (June 2019). "Critical Metals Ga, Ge and In: Experimental Evidence for Smelter Recovery Improvements". Minerals (İngilizce). 9 (6): 367. doi:10.3390/min9060367.
- ^ "D. I. Mendeleev's concept of chemical elements and The Principles of Chemistry" (PDF). Bulletin for the History of Chemistry. 27 (1): 4-16. 2002. 17 Aralık 2008 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 20 Ağustos 2008. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ a b c d e "Mittheilungen über des Germanium. Zweite Abhandlung". J. Prak. Chemie (Almanca). 36 (1): 177-209. 1887. doi:10.1002/prac.18870360119. 3 Kasım 2012 tarihinde kaynağından arşivlendi. Erişim tarihi: 20 Ağustos 2008. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ a b c d "Germanium, Ge, a New Nonmetal Element". Berichte der Deutschen Chemischen Gesellschaft (Almanca). 19 (1): 210-211. 1887. doi:10.1002/cber.18860190156. 7 Aralık 2008 tarihinde kaynağından arşivlendi. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "Germanium, a New Non-Metallic Element". The Manufacturer and Builder: 181. 1887. 19 Aralık 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 20 Ağustos 2008.
- ^ "Obituary: Clemens Winkler". Berichte der Deutschen Chemischen Gesellschaft (Almanca). 39 (4): 4491-4548. 1886. doi:10.1002/cber.190603904164. 1 Ağustos 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Haziran 2020. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "Sur le poids atomique du germanium". Comptes Rendus (Fransızca). 103: 452. 1886. 20 Haziran 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 20 Ağustos 2008. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ a b Haller, E. E. (14 Haziran 2006). "Germanium: From Its Discovery to SiGe Devices" (PDF). Department of Materials Science and Engineering, University of California, Berkeley, and Materials Sciences Division, Lawrence Berkeley National Laboratory, Berkeley. 10 Temmuz 2019 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 22 Ağustos 2008.
- ^ W. K. (10 Mayıs 1953). "Germanium for Electronic Devices". The New York Times. 13 Haziran 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Ağustos 2008.
- ^ "1941 – Semiconductor diode rectifiers serve in WW II". Computer History Museum. 24 Eylül 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Ağustos 2008.
- ^ "SiGe History". University of Cambridge. 5 Ağustos 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Ağustos 2008.
- ^ a b c d e "Germanium". Chemical & Engineering News. American Chemical Society. 2003. 13 Mayıs 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Ağustos 2008. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Brattain, W. H. (1948). "The Transistor, A Semi-Conductor Triode". Physical Review. 74 (2): 230-231. doi:10.1103/PhysRev.74.230. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım) - ^ "Electronics History 4 – Transistors". National Academy of Engineering. 20 Ekim 2007 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Ağustos 2008.
- ^ a b c d e f g h i j k l m n U.S. Geological Survey (2008). "Germanium – Statistics and Information". U.S. Geological Survey, Mineral Commodity Summaries. 16 Eylül 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Ağustos 2008.
Select 2008
- ^ "Single Crystals of Germanium and Silicon-Basic to the Transistor and Integrated Circuit". IEEE Transactions on Electron Devices. ED-23 (7): 621-639. July 1976. doi:10.1109/T-ED.1976.18464. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ a b Nature's Building Blocks. Oxford: Oxford University Press. 2001. ss. 506-510. ISBN 978-0-19-850341-5. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Agnese (27 Ağustos 2018). "Energy loss due to defect formation from 206Pb recoils in SuperCDMS germanium detectors". Applied Physics Letters. 113 (9): 092101. arXiv:1805.09942 $2. doi:10.1063/1.5041457. ISSN 0003-6951.
- ^ a b c d e f g h i Wiberg, E.; Wiberg, N. (2007). Lehrbuch der Anorganischen Chemie. 102nd. de Gruyter. ISBN 978-3-11-017770-1. OCLC 145623740. Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım) - ^ "Germanium". Los Alamos National Laboratory. 22 Haziran 2011 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Ağustos 2008.
- ^ Chardin, B. (2001). "Dark Matter: Direct Detection". Binetruy, B (Ed.). The Primordial Universe: 28 June – 23 July 1999. Springer. s. 308. ISBN 978-3-540-41046-1. r eksik
|soyadı1=(yardım) - ^ Lévy (August 2005). "Magnetic field-induced superconductivity in the ferromagnet URhGe". Science. 309 (5739): 1343-1346. doi:10.1126/science.1115498. PMID 16123293.
- ^ "Morphology of Germanium Whiskers". Kristall und Technik. 7 (1–3): 37–41. 1972. doi:10.1002/crat.19720070107. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Tabet, N (1998). "KRXPS study of the oxidation of Ge(001) surface". Applied Surface Science. 134 (1–4): 275-282. doi:10.1016/S0169-4332(98)00251-7.
- ^ Tabet, N (1999). "XPS study of the growth kinetics of thin films obtained by thermal oxidation of germanium substrates". Journal of Electron Spectroscopy and Related Phenomena. 101–103: 233-238. doi:10.1016/S0368-2048(98)00451-4.
- ^ a b c d e Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2. bas.). Butterworth-Heinemann. ISBN 0080379419.
- ^ Xu (1999). "Oxidative Coupling of Deltahedral [Ge9]4− Zintl Ions". J. Am. Chem. Soc. 121 (39): 9245-9246. doi:10.1021/ja992269s.
- ^ Sanghera, Jasbinder S.; Aggarwal, Ishwar D. (2002). "Infrared Transparent Germanate Glass-Ceramics". Journal of the American Ceramic Society. 85 (12): 3114-3116. doi:10.1111/j.1151-2916.2002.tb00594.x. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım) - ^ Drugoveiko (1975). "Infrared reflectance and transmission spectra of germanium dioxide and its hydrolysis products". Journal of Applied Spectroscopy. 22 (2): 191-193. doi:10.1007/BF00614256.
- ^ McIntyre, R. J.; Lecomte, R. (1986). "A Bismuth Germanate-Avalanche Photodiode Module Designed for Use in High Resolution Positron Emission Tomography". IEEE Transactions on Nuclear Science. 33 (1): 456-459. doi:10.1109/TNS.1986.4337142. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım) - ^ "Germanium and its Inorganic Compounds". Chem. Rev. 51 (3): 431-469. 1952. doi:10.1021/cr60160a002. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Fröba (1997). "First synthesis of mesostructured thiogermanates". Chemical Communications (18): 1729-1730. doi:10.1039/a703634e.
- ^ Jones, P.J.; Reid, G. (1998). "The Crystal Structure and Raman Spectrum of Ge5Cl12·GeCl4 and the Vibrational Spectrum of Ge2Cl6". Inorg. Chem. 37 (23): 6032-6034. doi:10.1021/ic9807341. PMID 11670739. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım) - ^ "Reactive intermediates in organogermanium chemistry". Pure Appl. Chem. 56 (1): 137-150. 1984. doi:10.1351/pac198456010137. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Bottei, Rudolph S. (1963). "Organogermanium Chemistry". Chemical Reviews. 63 (4): 403-442. doi:10.1021/cr60224a004. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım) - ^ a b Bolger, P. M. (June 1997). "Hazard Assessment of Germanium Supplements". Regulatory Toxicology and Pharmacology. 25 (3): 211-219. doi:10.1006/rtph.1997.1098. PMID 9237323. 10 Mart 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 30 Haziran 2019. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım) - ^ "Germanium-oxygen double bond takes centre stage". Chemistry World. 25 Mart 2012. 17 Mayıs 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Mayıs 2014. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ a b Perreault, Bruce A. "Alpha Fusion Electrical Energy Valve" 12 Ekim 2007 tarihinde Wayback Machine sitesinde arşivlendi., US Patent 7800286, issued September 21, 2010.
- ^ Şablon:NUBASE 2003
- ^ Dinerstein, Harriet L.; Bowers, Charles W. (2002). "Discovery of Enhanced Germanium Abundances in Planetary Nebulae with the Far Ultraviolet Spectroscopic Explorer". The Astrophysical Journal Letters. 578 (1): L55-L58. arXiv:astro-ph/0208516 $2. doi:10.1086/344473. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım) - ^ "Astronomy: Elements of surprise". Nature. 423 (29): 29. 1 Mayıs 2003. doi:10.1038/423029a. PMID 12721614. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Hanel, R.; Maguire, W. (1982). "The tropospheric gas composition of Jupiter's north equatorial belt /NH3, PH3, CH3D, GeH4, H2O/ and the Jovian D/H isotopic ratio". Astrophysical Journal. 263: 443-467. doi:10.1086/160516. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım) - ^ a b c d e Kling, M.; Schroll, E. (2007). "Metallogenesis of germanium – A review". Ore Geology Reviews. 30 (3–4): 145-180. doi:10.1016/j.oregeorev.2005.07.034. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım) - ^ Frenzel (2016). "The distribution of gallium, germanium and indium in conventional and non-conventional resources – Implications for global availability (PDF Download Available)". ResearchGate. Unpublished. doi:10.13140/rg.2.2.20956.18564. 6 Ekim 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 10 Haziran 2017.
- ^ Roberts ve diğerleri. (December 2004). "Eyselite, Fe3+Ge34+O7(OH), a new mineral species from Tsumeb, Namibia". The Canadian Mineralogist. 42 (6): 1771-1776. doi:10.2113/gscanmin.42.6.1771. 7 Temmuz 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Temmuz 2023.
- ^ "Archived copy" (PDF). 6 Ekim 2018 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 6 Ekim 2018.
- ^ "Archived copy" (PDF). 20 Mart 2020 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 6 Ekim 2018.
- ^ a b "Ueber das Vorkommen des Germaniums in Steinkohlen und Steinkohlenprodukten". Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse: 141-167. 1930. 3 Mart 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Ağustos 2008. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ a b Peters, Cl. (1933). "Zur Geochemie des Germaniums". Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse: 141-167. 1 Aralık 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Ağustos 2008. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım) - ^ Bernstein, L (1985). "Germanium geochemistry and mineralogy". Geochimica et Cosmochimica Acta. 49 (11): 2409-2422. doi:10.1016/0016-7037(85)90241-8.
- ^ Frenzel (July 2016). "Gallium, germanium, indium and other minor and trace elements in sphalerite as a function of deposit type – A meta-analysis". Ore Geology Reviews. 76: 52-78. doi:10.1016/j.oregeorev.2015.12.017.
- ^ Frenzel (29 Aralık 2013). "On the geological availability of germanium". Mineralium Deposita. 49 (4): 471-486. doi:10.1007/s00126-013-0506-z. ISSN 0026-4598.
- ^ Frenzel (19 Ocak 2014). "Erratum to: On the geological availability of germanium". Mineralium Deposita. 49 (4): 487. doi:10.1007/s00126-014-0509-4. ISSN 0026-4598.
- ^ R.N. Soar (1977). USGS Minerals Information. U.S. Geological Survey Mineral Commodity Summaries. ISBN 978-0-85934-039-7. OCLC 16437701. 7 Mayıs 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Nisan 2013.
- ^ a b c "World market of germanium and its prospects". Russian Journal of Non-Ferrous Metals. 48 (4): 265-272. 2007. doi:10.3103/S1067821207040049. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ a b Moskalyk, R. R. (2004). "Review of germanium processing worldwide". Minerals Engineering. 17 (3): 393-402. doi:10.1016/j.mineng.2003.11.014.
- ^ "Infrared Detector Arrays for Astronomy". Annual Review of Astronomy and Astrophysics. 45 (1): 77-115. 2007. doi:10.1146/annurev.astro.44.051905.092436. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ a b c "Germanium" (PDF). U.S. Geological Survey. 2000. 8 Haziran 2011 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 22 Eylül 2008. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "Chapter III: Optical Fiber For Communications" (PDF). Stanford Research Institute. 5 Aralık 2014 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 22 Ağustos 2008.
- ^ "Understanding Recordable & Rewritable DVD" (PDF). First. Optical Storage Technology Association (OSTA). 19 Nisan 2009 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 22 Eylül 2008.
- ^ "Applications of diamond-like carbon thin films". Carbon. 36 (5–6): 555-560. 1998. doi:10.1016/S0008-6223(98)00062-1. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Bonnie L. Soriano; Steven H. Propst (1990). Holly, Sandor (Ed.). "Study on correlating rain erosion resistance with sliding abrasion resistance of DLC on germanium". Proc. SPIE. SPIE Proceedings. 1325 (Mechanical Properties): 99. doi:10.1117/12.22449. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım); r eksik|soyadı1=(yardım) - ^ "SiGe HBT and BiCMOS technologies for optical transmission and wireless communication systems". IEEE Transactions on Electron Devices. 50 (3): 656-668. 2003. doi:10.1109/TED.2003.810484. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Bailey (2002). "Space and terrestrial photovoltaics: synergy and diversity". Progress in Photovoltaics: Research and Applications. 10 (6): 399-406. doi:10.1002/pip.446.
- ^ Pathare, A.; Ewell, R. C. (January 2004). "The performance of gallium arsenide/germanium solar cells at the Martian surface". Acta Astronautica. 54 (2): 83-101. doi:10.1016/S0094-5765(02)00287-4. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım) - ^ Wu (August 2016). "Fully Depleted Ge CMOS Devices and Logic Circuits on Si" (PDF). IEEE Transactions on Electron Devices. 63 (8): 3028-3035. doi:10.1109/TED.2016.2581203. 6 Mart 2019 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 4 Mart 2019.
- ^ Szweda, Roy (2005). "Germanium phoenix". III-Vs Review. 18 (7): 55. doi:10.1016/S0961-1290(05)71310-7.
- ^ Zhao (21 Temmuz 2022). "Biodegradable germanium electronics for integrated biosensing of physiological signals". NPJ Flexible Electronics. 6. doi:10.1038/s41528-022-00196-2.
- ^ a b "The Current Status of Catalysis and Catalyst Development for the Industrial Process of Poly(ethylene terephthalate) Polycondensation". International Journal of Polymeric Materials. 50 (3): 387-394. 2001. doi:10.1080/00914030108035115. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Fang (2007). "Germania-Based, Sol-Gel Hybrid Organic-Inorganic Coatings for Capillary Microextraction and Gas Chromatography". Anal. Chem. 79 (24): 9441-9451. doi:10.1021/ac071056f. PMID 17994707.
- ^ "Performance of Light-Weight, Battery-Operated, High Purity Germanium Detectors for Field Use" (PDF). Oak Ridge Technical Enterprise Corporation (ORTEC). 26 Ekim 2007 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 6 Eylül 2008.
- ^ Ahmed (1996). "Optimization of Germanium for Neutron Diffractometers". International Journal of Modern Physics E. 5 (1): 131-151. doi:10.1142/S0218301396000062.
- ^ Diehl (2006). "Astrophysical constraints from gamma-ray spectroscopy". Nuclear Physics A. 777 (2006): 70-97. arXiv:astro-ph/0502324 $2. doi:10.1016/j.nuclphysa.2005.02.155.
- ^ Eugene P. Bertin (1970).
- ^ Shen (18 Ekim 2010). "Spin transport in germanium at room temperature" (PDF). Applied Physics Letters. 97 (16): 162104. doi:10.1063/1.3505337. ISSN 0003-6951. 22 Eylül 2017 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 16 Kasım 2018.
- ^ Sigillito (7 Aralık 2015). "Electron Spin Coherence of Shallow Donors in Natural and Isotopically Enriched Germanium". Physical Review Letters. 115 (24): 247601. arXiv:1506.05767 $2. doi:10.1103/PhysRevLett.115.247601. PMID 26705654.
- ^ The products/compounds targeted are: germanium dioxide, germanium epitaxial growth substrate, germanium ingot, germanium metal, germanium tetrachloride and zinc germanium phosphide.
- ^ China restricts exports of two metals that the EU considers of 'strategic' importance 6 Temmuz 2023 tarihinde Wayback Machine sitesinde arşivlendi., Euronews, 4 July 2023.
- ^ China hits back in the chip war, imposing export curbs on crucial raw materials 5 Temmuz 2023 tarihinde Wayback Machine sitesinde arşivlendi., CNN, 3 July 2023.
- ^ China to restrict exports of chipmaking materials as US mulls new curbs 5 Temmuz 2023 tarihinde Wayback Machine sitesinde arşivlendi., Reuters, 4 Juy 2023.
- ^ a b Ades TB, (Ed.) (2009). "Germanium". American Cancer Society Complete Guide to Complementary and Alternative Cancer Therapies. 2nd. American Cancer Society. ss. 360-363. ISBN 978-0944235713. r eksik
|soyadı1=(yardım) - ^ Baselt, R. (2008). Disposition of Toxic Drugs and Chemicals in Man. 8th. Foster City, CA: Biomedical Publications. ss. 693-694.
- ^ Léonard, A. (1997). "Mutagenicity, carcinogenicity and teratogenicity of germanium compounds". Regulatory Toxicology and Pharmacology. 387 (3): 141-146. doi:10.1016/S1383-5742(97)00034-3. PMID 9439710. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım)





