Galanin
Galanin, memelilerde yüksek oranda korunmuş GAL geni tarafından kodlanan 29 aminoasit uzunluğunda bir nöropeptittir. Merkezi sinir sistemi ve periferik dokular boyunca geniş çapta dağılım göstermektedir.[1] Galanin nöropeptidi, fizyolojik ve patolojik etkilerini G proteine bağlı reseptörlerle etkileşim yoluyla düzenlemektedir. GAL1, GAL2 ve GAL3 olmak üzere galanin reseptörlerinin üç alt tipi mevcuttur. Nöropeptidin reseptörlere bağlanması sonucu, siklik AMP/protein kinaz A yolağının baskılanması ve fosfolipaz C'nin aktivasyonunu içeren çoklu transdüksiyon yollarıyla sinyal gönderilmektedir.[2]
Galaninerjik sistem gıda alımının kontrolü, nöronal koruma ve yenilenme, enerji harcanması, üreme, ozmotik düzenleme ve su alımı, stres ve anksiyete, nosisepsiyon ve çeşitli nöroendokrin fonksiyonların dahil olduğu biyolojik işlevlerde rol oynamaktadır.[3] Hipotalamusta yer alan galanin nöronları uyku homeostazının sağlanması için gereklidir. Galanin nöronları lezyonlu farelerde hızlı göz hareketlerinin olmadığı uyku döneminin süresi azalmaktadır.[4] Endokrin hormon özelliği gösteren galanin, üreme hormonlarının sentezini ve salgılanmasını düzenleyebilmektedir. Gonadotropin salgılatıcı hormon seviyesini kontrol ederek lüteinleştirici hormon ve gonadal hormon salınımını tetikleyebilmektedir.[5]
Deneysel çalışmalar, galaninin alternatif tedavi yöntemleri geliştirilmesinde etkili olabileceğine işaret etmektedir. Galanin sinyal yollarını hedefleyen terapötik müdahaleler, duygu durum bozukluklarından obeziteye kadar değişen hastalıkların tedavisine katkıda bulunabilir.[6] Galanin peptitleri, glukoz dengesini kontrol ederek metabolik süreçlerde de etkili olabilmektedir. Son dönemde, insülin direncinin ve tip 2 diyabetin iyileştirilmesinde galanin sinyalizasyonunun farmakolojik aktivasyonu terapötik bir hedef olarak değerlendirilmektedir.[7] Sindirim sistemi bozukluklarında galanin seviyelerinde dalgalanmalar görülmektedir. Galaninin bağışıklığı düzenleyici etkisi ele alındığında yemek borusu, mide, ince ve kalın bağırsağın dahil olduğu sindirim kanalı boyunca oluşan iltihabi hastalıkların tedavisi için yeni yaklaşımlar sunabileceği öngörülmektedir.[8]
Galaninin Keşfi
Galeninerjik sistemin temel molekülü olan galanin peptidi, ilk olarak Tatemato ve ark. tarafından domuz bağırsak özütünden izole edilmiştir. Peptit, kimyasal yöntemlerle C-terminal amid yapısının saptanmasıyla keşfedilmiştir.[9]
Galaninin Yapısı
Galanin domuzlarda ve diğer türlerde 29 amino asit rezidüsünden oluşmaktadır. İnsanlarda ise peptidin C-terminalinde amidasyon içermeyen 30 aminoasitli bir moleküldür. Olgun galanin peptidi, 123 aminoasit kalıntısı içeren prepro-galaninden türetilmektedir.[10] Galaninin, N-terminal ucu biyolojik aktivitesini gerçekleştirebilmesi için önemlidir. Türler arasında ilk 15 amino asit korunmaktadır.[11] Ek olarak, 1999 yılında domuz hipotalamusundan galanin benzeri peptit (GALP) elde edilmiştir. GALP molekülü, galanin ile benzer dizi homolojisi göstermektedir. 115-120 amino asitli bir polipeptit öncüsünden üretilen GALP, insanlarda 60 amino asitlik bir peptittir.[12]
Galanin Reseptörleri
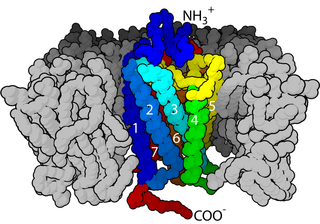
Galanin peptidi, üç reseptör alt tipine (GalR1, GalR2 ve GalR3) sahiptir. Tüm alt tipler, G-proteine bağlı reseptör ailesinin üyeleri arasındadır.[13] GalR1 ve GalR3 alt tipleri G0/i proteiniyle adenilat siklaz aktivitesini etkilerken GalR2 alt tipi Gq/11 proteiniyle fosfolipaz C yolağını uyarmaktadır.[14] Reseptör alt tipleri farklı sinyalizasyon yolaklarını tetikleyerek dokularda değişen fizyolojik etkiler gösterebilmektedir.

Galanin reseptör alt tiplerinin sinyal yolakları. Galanin reseptörleri G-proteine bağlı reseptör ailesinin üyeleridir. Galaninin, GalR1 ve GalR3 alt tiplerine bağlanmasıyla Gα proteini GTP ilişkili aktif formuna dönüşür. G0/i molekülü adenilat siklaza bağlanarak ATP'den sAMP oluşumunu uyarır. Artan sAMP ikinci haberci olarak hücresel sinyalizasyonu sağlamaktadır. Galanin GalR1 alt tipiyle etkileştiğinde benzer şekilde GTP molekülü Gα alt birimini aktifleştirir. Gq/11 proteini fosfolipaz C'ye bağlarak membrandaki PIP2 molekülünün IP3 ve DAG'a ayrışmasını tetikler. Oluşan sinyal moleküleri galaninin hücresel işlevini göstermesine aracılık eder. ATP, adenozin trifosfat; DAG, diaçilgliserol; GalR, galanin reseptörü; GTP, guanosin trifosfat; IP3, inositol trisfosfat; PIP2, fosfatidilinozitol-4,5-bisfosfat; PLC, fosfolipaz C; sAMP, siklik adenozin monofosfat.
Galanin reseptörü tip 1 (GalR1)
Reseptörün dokulardaki dağılımı
GalR1 molekülü, insan melanom hücrelerinde şimdiye kadar bilinen ilk galanin reseptörü olarak tanımlanmıştır.[15] GalR1 talamus, hipotalamus, amigdala, koku alma yapıları, pons, medulla ve omurilik gibi merkezi sinir sistemi dokularına ifade edilmektedir.[16]
Reseptörün işlevi
GalR1 gastrointestinal sistemde motilite ve sekresyonu düzenleyebilmektedir. GalR1 agonisti ile muamele edilen ince bağırsak hücrelerinde, glukagon benzeri peptit 1 ve glukoza bağımlı insülinotropik polipeptit salgılanmasının baskılandığı ortaya koyulmuştur.[17] GalR1 aracılı iletim bağırsak hormonlarını etkileyerek glukoz metabolizmasını kontrol edebilir. Merkezi sinir sistemindeki nöropatik ağrının kontrolünde galanin sinyalizasyonu önem taşımaktadır. Nöropatili sıçanlarda GalR1 yukarı düzenlenmektedir. Sıçanlarda amigdalanın merkezi çekirdeğine GalR1 agonisti uygulandığında termal ve mekanik uyarılara tepkinin geciktiği belirlenmiştir.[18] GalR1 molekülünün sinir hasarlanması durumunda antinosisepsiyona aracılık edebileceği düşünülmektedir.
Reseptörün ilişkili olduğu hastalıklar
Doğum sonrası sıçan depresyon modelinde, prefrontal kortekste GalR1 ifadesinin arttığı bildirilmektedir. GalR1 ifadesinin azaltılmasının serotonerjik sistemin aktivitesini düzenleyerek depresyonu baskılayıcı etkiler gösterdiği ortaya koyulmuştur. Galaninerjik sistem diğer nörotransmitterlerin seviyesini değiştirerek stres, anksiyete ve duygu durum bozuklukları gibi hastalıkların moleküler mekanizmasında rol oynayabilir.[19] Strese bağlı olarak kalp dokusunda galanin reseptörü ifadesinin değişebileceği ileri sürülmektedir. Üç farklı stres modelinde sıçanlara ait kalp örneklerinde GalR1 ifadesinin anlamlı olarak azaldığı belirlenmiştir. Bu bağlamda, galanin reseptörlerinin stres durumunda kalp döngüsünün düzenlenmesinde işlevi olabileceği öngörülmektedir.[14] Galanin, stresle ilişkili kalp problemlerinde etkili olabilir.
Reseptör ilişkili tedavi yaklaşımları
GalR1 sinyalizasyonu, hücre çoğalmasının kontrolüne katkı sağlayabilmektedir. Genetik müdahaleyle GalR1 ifade etmesi sağlanan insan oral karsinom hücre hattında, reseptörün Gi proteiniyle ERK1/2 yolağını aktive ederek hücre çoğalmasını baskıladığı belirlenmiştir. İleri moleküler çalışmalarla, GalR1 molekülünün kanser tedavisinde tümör baskılayıcı etkisi değerlendirilmelidir.[20]
Galanin reseptörü tip 2 (GalR2)
Reseptörün dokulardaki dağılımı
GalR2 molekülü, merkezi sinir sisteminde yaygın olarak ifade edilmektedir. Hipokampüs, girus dentatus, arkuat çekirdek, spinal trigeminal yol ve dorsal vagus sinirinde GalR2 mRNA'sı bulunmaktadır.[21]
Reseptörün işlevi
Galanin sinyalizasyonu, sinir sisteminde ağrı yanıtlarının düzenlenmesinde etkilidir. Mononöropatisi olan sıçanların anterior singulat korteksinde GalR2 mRNA ifadesinin anlamlı olarak yükseldiği belirlenmiştir. Singulat kortekse galanin enjeksiyonunun ağrılı uyarana karşı arka ayak çekilmesinin gecikmesini arttırdığı ortaya koyulmuştur.[22] Galanin peptidinin, GalR1 ve GalR2 molekülleriyle etkileşerek periferik sinir sisteminde nosisepsiyonu düzenleyebileceği öngörülmektedir.
Reseptörün ilişkili olduğu hastalıklar
Galanin uyarılabilirliğin düzenlenmesinde etkili olabilir. İntrahipokampal kainik asit injeksiyonu yapılan ve GalR2 ifadesi baskılanan farelerde nöbet sayısının ve süresinin arttığı gözlemlenmiştir.[23] GalR2 molekülüne afinitesi arttırılan farelere galanin peptidinin intraperitonal uygulanmasının antikonvulsant etki gösterdiği bilinmektedir.[24] Epileptik nöbetlerin baskılanması/önlenmesi için galanin transmisyonun arttırılmasını hedefleyen farmakolojik yaklaşımlar geliştirilebilir.
Reseptör ilişkili tedavi yaklaşımları
Galanin ve reseptörleri, Alzheimer hastalığında bilişsel bozulmayla ilişkili hasarlı beyin bölgelerinde yüksek düzeyde ifade edilmektedir.[25] Bununla birlikte, GalR2 molekülünün Akt ve ERK aktivasyonuyla apoptozu azaltabileceği ileri sürülmektedir.[26] Bu doğrultuda, endojen GalR2 artışı Alzheimer gibi beyin hasarıyla seyreden nörolojik hastalıklarda sinir hücrelerinin sağ kalımını arttırabilir. Galaninerjik sistem metabolik süreçleri de etkileyebilmektedir. Galanin uygulaması sıçanlarda glikoz taşıyıcısını etkileyerek insülin direncini azaltabilmektedir. Tip 2 diyabet modeli oluşturulan sıçanlara GalR2 agonisti verilmesinin glikoz infüzyonunu arttırırken plazmadaki inflamasyon düzeyini azalttığı belirlenmiştir.[27] Serebral ventriküllerine GalR2 agonisti enjekte edilen diyabetik sıçanların yağ hücrelerinde insüline karşı düşük direnç olduğu ortaya koyulmuştur.[28] Bu bağlamda, insülin direncinin azaltılması ve tip 2 diyabet tedavisinde GalR2 agonistleri uygulaması alternatif bir yaklaşım sağlayabilir.
Galanin reseptörü tip 3 (GalR3)
Reseptörün dokulardaki dağılımı
GalR3 molekülü merkezi sinir sisteminde düşük düzeyde ifade edilmektedir. Yoğunluklu olarak hipotalamusun paraventriküler, ventromedial ve dorsomedial çekirdelerinde GalR3 mRNA' sı üretilmektedir[29]
Reseptörün işlevi
Farelerde mukozal mast hücresi farklılaşmasında galaninin rolü olabileceği ileri sürülmektedir. Farelerin kemik iliğinden elde edilen mast hücrelerinin GalR3 düzeyiyle ilişkili olarak mukozal tip mast hücrelerine dönüştüğü ortaya koyulmuştur. Bağ dokusu tipi mast hücrelerine kıyasla mukozal tip mast hücrelerinde GalR3 ifadesinin yüksek olduğu belirlenmiştir.[30]
Reseptörün ilişkili olduğu hastalıklar
Galaninin anksiyete patogeneziyle ilişkili olabileceğine dair çalışmalar mevcuttur. Genetik müdahaleyle GalR3 ifadesi silinen farelerin davranış testlerinde anksiyete benzeri fenotip sergilediği gözlemlenmiştir. Sosyal etkileşim testinde ise mutasyonlu farelerin yabancı farelere karşı daha az sosyal oldukları bildirilmiştir.[31] Anksiyetenin moleküler mekanizmasında ve sosyal etkileşim kalıplarının belirlenmesinde galaninerjik sistemin etkisi olabilir.
Reseptör ilişkili tedavi yaklaşımları
Galaninerjik sistem, derinin ve organların iltihabi süreçleri ile ilişkilendirilmektedir. Genetik olarak GalR3 üretimi engellenen ve sedef hastalığı modeli oluşturulan farelere, imikimod tedavisi uygulandığında hastalığın şiddetinin azaldığı gözlemlenmiştir. Yeni damar oluşumunun ve nötrofil birikiminin baskılandığı ortaya koyulmuştur.[32] Bu bağlamda, GalR3 aracılı sinyal iletim vasküler ve iltihabi süreçleri kontrol etmesi bakımından deri hastalıklarında terapötik bir hedef olarak belirlenebilir.
| Reseptör alt birimi | İşlev | Hastalık | Tedavi |
|---|---|---|---|
| GalR1 | GİS motilitesi, sekresyon, glukoz metabolizması, nosisepsiyon, hücre çoğalması | Depresyon, Stres, nöropatik ağrı | Kanser tedavisi |
| GalR2 | Nosisepsiyon, sinir hücresi sağ kalımı | Epilepsi, mononöropati | Alzheimer Hastalığı, insülin direnci, tip 2 diyabet |
| GalR3 | Mast hücre farklılaşması | Anksiyete | Sedef hastalığı, iltihabi hastalıklar |
GalR, galanin reseptörü; GİS, gastrointestinal sistem.
Kaynakça
- ^ Schmidt, W E; Kratzin, H; Eckart, K; Drevs, D; Mundkowski, G; Clemens, A; Katsoulis, S; Schäfer, H; Gallwitz, B; Creutzfeldt, W (15 Aralık 1991). "Isolation and primary structure of pituitary human galanin, a 30-residue nonamidated neuropeptide". Proceedings of the National Academy of Sciences of the United States of America. 88 (24): 11435-11439. ISSN 0027-8424. PMID 1722333.
- ^ Lang, Roland; Gundlach, Andrew L.; Holmes, Fiona E.; Hobson, Sally A.; Wynick, David; Hökfelt, Tomas; Kofler, Barbara (1 Ocak 2015). "Physiology, Signaling, and Pharmacology of Galanin Peptides and Receptors: Three Decades of Emerging Diversity". Pharmacological Reviews (İngilizce). 67 (1): 118-175. doi:10.1124/pr.112.006536. ISSN 0031-6997. PMID 25428932. 8 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Mayıs 2021.
- ^ Demsie, Desalegn Getnet; Altaye, Birhanetensay Masresha; Weldekidan, Etsay; Gebremedhin, Hagazi; Alema, Niguse Meles; Tefera, Mulugeta Mihrete; Bantie, Abere Tilahun (21 Nisan 2020). "Galanin Receptors as Drug Target for Novel Antidepressants: Review". Biologics : Targets & Therapy. 14: 37-45. doi:10.2147/BTT.S240715. ISSN 1177-5475.
- ^ Ma, Ying; Miracca, Giulia; Yu, Xiao; Harding, Edward C.; Miao, Andawei; Yustos, Raquel; Vyssotski, Alexei L.; Franks, Nicholas P.; Wisden, William (7 Ekim 2019). "Galanin Neurons Unite Sleep Homeostasis and α2-Adrenergic Sedation". Current biology: CB. 29 (19): 3315-3322.e3. doi:10.1016/j.cub.2019.07.087. ISSN 1879-0445. PMID 31543455. 10 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Mayıs 2021.
- ^ Fang, Penghua; He, Biao; Shi, Mingyi; Kong, Guimei; Dong, Xiaoyun; Zhu, Yan; Bo, Ping; Zhang, Zhenwen (15 Temmuz 2015). "The regulative effect of galanin family members on link of energy metabolism and reproduction". Peptides. 71: 240-249. doi:10.1016/j.peptides.2015.07.007. ISSN 1873-5169. PMID 26188174. 8 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Mayıs 2021.
- ^ Mills, Edouard G.; Izzi-Engbeaya, Chioma; Abbara, Ali; Comninos, Alexander N.; Dhillo, Waljit S. (3 Aralık 2020). "Functions of galanin, spexin and kisspeptin in metabolism, mood and behaviour". Nature Reviews Endocrinology (İngilizce). 17 (2): 97-113. doi:10.1038/s41574-020-00438-1. ISSN 1759-5037. 27 Aralık 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Mayıs 2021.
- ^ Fang, Penghua; Yu, Mei; Shi, Mingyi; Bo, Ping; Zhang, Zhenwen (6 Kasım 2019). "Galanin peptide family regulation of glucose metabolism". Frontiers in Neuroendocrinology. 56: 100801. doi:10.1016/j.yfrne.2019.100801. ISSN 1095-6808. PMID 31705911. 8 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Mayıs 2021.
- ^ Brzozowska, Marta; Całka, Jarosław (2021). "Review: Occurrence and Distribution of Galanin in the Physiological and Inflammatory States in the Mammalian Gastrointestinal Tract". Frontiers in Immunology (İngilizce). 11. doi:10.3389/fimmu.2020.602070. ISSN 1664-3224. 8 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Mayıs 2021.
- ^ Tatemoto, K.; Rökaeus, A.; Jörnvall, H.; McDonald, T. J.; Mutt, V. (28 Kasım 1983). "Galanin - a novel biologically active peptide from porcine intestine". FEBS letters. 164 (1): 124-128. doi:10.1016/0014-5793(83)80033-7. ISSN 0014-5793. PMID 6197320.
- ^ Burgevin, M. C.; Loquet, I.; Quarteronet, D.; Habert-Ortoli, E. (1995). "Cloning, pharmacological characterization, and anatomical distribution of a rat cDNA encoding for a galanin receptor". Journal of molecular neuroscience: MN. 6 (1): 33-41. doi:10.1007/BF02736757. ISSN 0895-8696. PMID 8562318. 10 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Mayıs 2021.
- ^ "Role of galanin receptor 1 in peristaltic activity in the guinea pig ileum". Neuroscience (İngilizce). 125 (1): 103-112. 1 Ocak 2004. doi:10.1016/j.neuroscience.2003.12.043. ISSN 0306-4522. 8 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Mayıs 2021.
- ^ Ohtaki, T.; Kumano, S.; Ishibashi, Y.; Ogi, K.; Matsui, H.; Harada, M.; Kitada, C.; Kurokawa, T.; Onda, H.; Fujino, M. (24 Aralık 1999). "Isolation and cDNA cloning of a novel galanin-like peptide (GALP) from porcine hypothalamus". The Journal of Biological Chemistry. 274 (52): 37041-37045. doi:10.1074/jbc.274.52.37041. ISSN 0021-9258. PMID 10601261. 8 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Mayıs 2021.
- ^ Webling, Kristin E. B.; Runesson, Johan; Bartfai, Tamas; Langel, Ulo (2012). "Galanin receptors and ligands". Frontiers in Endocrinology. 3: 146. doi:10.3389/fendo.2012.00146. ISSN 1664-2392. PMC 3516677 $2. PMID 23233848. 8 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Mayıs 2021.
- ^ a b "Europe PMC". europepmc.org. 8 Haziran 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Mayıs 2021.
- ^ Habert-Ortoli, E.; Amiranoff, B.; Loquet, I.; Laburthe, M.; Mayaux, J. F. (11 Ekim 1994). "Molecular cloning of a functional human galanin receptor". Proceedings of the National Academy of Sciences (İngilizce). 91 (21): 9780-9783. doi:10.1073/pnas.91.21.9780. ISSN 0027-8424. PMID 7524088. 10 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Mayıs 2021.
- ^ "Distribution and regulation of galanin receptor 1 messenger RNA in the forebrain of wild type and galanin-transgenic mice". Neuroscience (İngilizce). 117 (1): 105-117. 17 Mart 2003. doi:10.1016/S0306-4522(02)00798-4. ISSN 0306-4522. 10 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Mayıs 2021.
- ^ Psichas, Arianna; Glass, Leslie L.; Sharp, Stephen J.; Reimann, Frank; Gribble, Fiona M. (2016). "Galanin inhibits GLP-1 and GIP secretion via the GAL1 receptor in enteroendocrine L and K cells". British Journal of Pharmacology (İngilizce). 173 (5): 888-898. doi:10.1111/bph.13407. ISSN 1476-5381. PMC 4761093 $2. PMID 26661062.[]
- ^ Li, Shi-Yang; Huo, Mei-Ling; Wu, Xu-Yang; Huang, Yu-Qing; Wang, Lei; Zhang, Xin; Jiang, Yan-Mei; Zhang, Meng-Lin; Wang, Lin-Lin; Yu, Long-Chuan (10 Kasım 2017). "Involvement of galanin and galanin receptor 1 in nociceptive modulation in the central nucleus of amygdala in normal and neuropathic rats". Scientific Reports (İngilizce). 7 (1): 15317. doi:10.1038/s41598-017-13944-6. ISSN 2045-2322.
- ^ Li, Hui; Wang, Tong; Shi, Cuige; Yang, Yutao; Li, Xiaoxiao; Wu, Yan; Xu, Zhi-Qing David (2018). "Inhibition of GALR1 in PFC Alleviates Depressive-Like Behaviors in Postpartum Depression Rat Model by Upregulating CREB-BNDF and 5-HT Levels". Frontiers in Psychiatry (İngilizce). 9. doi:10.3389/fpsyt.2018.00588. ISSN 1664-0640. 8 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Mayıs 2021.
- ^ Kanazawa, T.; Iwashita, T.; Kommareddi, P.; Nair, T.; Misawa, K.; Misawa, Y.; Ueda, Y.; Tono, T.; Carey, T. E. (26 Mart 2006). "Galanin and galanin receptor type 1 suppress proliferation in squamous carcinoma cells: activation of the extracellular signal regulated kinase pathway and induction of cyclin-dependent kinase inhibitors". Oncogene (İngilizce). 26 (39): 5762-5771. doi:10.1038/sj.onc.1210384. ISSN 1476-5594.
- ^ Burazin, Tanya C. D.; Gundlach, Andrew L. (1998). "Inducible Galanin and GalR2 Receptor System in Motor Neuron Injury and Regeneration". Journal of Neurochemistry (İngilizce). 71 (2): 879-882. doi:10.1046/j.1471-4159.1998.71020879.x. ISSN 1471-4159.
- ^ Zhang, Meng-Lin; Wang, Hong-Bo; Fu, Feng-Hua; Yu, Long-Chuan (5 Nisan 2017). "Involvement of galanin and galanin receptor 2 in nociceptive modulation in anterior cingulate cortex of normal rats and rats with mononeuropathy". Scientific Reports (İngilizce). 7 (1): 45930. doi:10.1038/srep45930. ISSN 2045-2322. 19 Mayıs 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 10 Mayıs 2021.
- ^ Robertson, Charles R.; Scholl, Erika Adkins; Pruess, Timothy H.; Green, Brad R.; White, H. Steve; Bulaj, Grzegorz (25 Şubat 2010). "Engineering Galanin Analogues that Discriminate Between GalR1 and GalR2 Receptor Subtypes and Exhibit Anticonvulsant Activity Following Systemic Delivery". Journal of medicinal chemistry. 53 (4): 1871-1875. doi:10.1021/jm9018349. ISSN 0022-2623. PMC 2846716 $2. PMID 20121116. 3 Temmuz 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Mayıs 2021.
- ^ Drexel, Meinrad; Locker, Felix; Kofler, Barbara; Sperk, Günther (8 Ekim 2018). "Effects of galanin receptor 2 and receptor 3 knockout in mouse models of acute seizures". Epilepsia. 59 (11): e166-e171. doi:10.1111/epi.14573. ISSN 0013-9580. PMC 6282553 $2. PMID 30298565.
- ^ Counts, Scott E.; Perez, Sylvia E.; Ginsberg, Stephen D.; Mufson, Elliott J. (2010). "Neuroprotective role for galanin in Alzheimer's disease". Experientia Supplementum (2012). 102: 143-162. doi:10.1007/978-3-0346-0228-0_11. ISSN 1664-431X. PMC 3117305 $2. PMID 21299067. 10 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Mayıs 2021.
- ^ Elliott-Hunt, Caroline R.; Pope, Robert J. P.; Vanderplank, Penny; Wynick, David (2 Ekim 2006). "Activation of the galanin receptor 2 (GalR2) protects the hippocampus from neuronal damage: GalR2 and hippocampal neuroprotection". Journal of Neurochemistry (İngilizce). 100 (3): 780-789. doi:10.1111/j.1471-4159.2006.04239.x. PMC 2705497 $2. PMID 17263796.
- ^ "Central galanin receptor 2 mediates galanin action to promote systemic glucose metabolism of type 2 diabetic rats,Biochemical Pharmacology - X-MOL". www.x-mol.com (Çince). 8 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Mayıs 2021.
- ^ Guo, L.; He, B.; Fang, P.; Bo, P.; Zhang, Z. (1 Mart 2021). "Activation of central galanin receptor 2 mitigated insulin resistance in adipocytes of diabetic rats". Journal of Endocrinological Investigation (İngilizce). 44 (3): 515-522. doi:10.1007/s40618-020-01336-z. ISSN 1720-8386.
- ^ Mennicken, Françoise; Hoffert, Cyrla; Pelletier, Manon; Ahmad, Sultan; O'Donnell, Dajan (17 Temmuz 2002). "Restricted distribution of galanin receptor 3 (GalR3) mRNA in the adult rat central nervous system". Journal of Chemical Neuroanatomy. 24 (4): 257-268. doi:10.1016/s0891-0618(02)00068-6. ISSN 0891-0618. PMID 12406501. 9 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Mayıs 2021.
- ^ Yamaguchi, Tomoko; Ikeda, Yumi; Tashiro, Katsuhisa; Ohkawa, Yasuyuki; Kawabata, Kenji (2020). "The role of galanin in the differentiation of mucosal mast cells in mice". European Journal of Immunology (İngilizce). 50 (1): 110-118. doi:10.1002/eji.201848061. ISSN 1521-4141.
- ^ Brunner, Susanne M.; Farzi, Aitak; Locker, Felix; Holub, Barbara S.; Drexel, Meinrad; Reichmann, Florian; Lang, Andreas A.; Mayr, Johannes A.; Vilches, Jorge J.; Navarro, Xavier; Lang, Roland (13 Mayıs 2014). "GAL3 receptor KO mice exhibit an anxiety-like phenotype". Proceedings of the National Academy of Sciences of the United States of America. 111 (19): 7138-7143. doi:10.1073/pnas.1318066111. ISSN 0027-8424. PMC 4024886 $2. PMID 24782539.
- ^ "Lack of Galanin Receptor 3 Alleviates Psoriasis by Altering Vascularization, Immune Cell Infiltration, and Cytokine Expression". Journal of Investigative Dermatology (İngilizce). 138 (1): 199-207. 1 Ocak 2018. doi:10.1016/j.jid.2017.08.015. ISSN 0022-202X. 10 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Mayıs 2021.