Gümüş nitrat
 | |
 | |
| Adlandırmalar | |
|---|---|
Gümüş(I) nitrat, Gümüş nitrat | |
Diğer adlar Nitrik asit gümüş(1+) tuzu Cehennem taşı | |
| Tanımlayıcılar | |
CAS numarası | |
3D model (JSmol) | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.028.958 |
| EC Numarası |
|
PubChem CID | |
| RTECS numarası |
|
| UNII | |
| UN numarası | 1493 |
CompTox Bilgi Panosu (EPA) | |
| |
| |
| Özellikler | |
| Kimyasal formül | AgNO3 |
| Molekül kütlesi | 169,87 g mol−1 |
| Görünüm | renksiz katı |
| Koku | Kokusuz |
| Yoğunluk | 4.35 g/cm3 (24 °C) 3.97 g/cm3 (210 °C)[1] |
| Erime noktası | 209.7 °C[1][2] |
| Kaynama noktası | 440 °C bozunur[1] |
| Çözünürlük (su içinde) | 122 g/100 mL (0 °C) 170 g/100 mL (10 °C) 256 g/100 mL (25 °C) 373 g/100 mL (40 °C) 912 g/100 mL (100 °C)[3] |
| Çözünürlük | aseton,[1] amonyak, eter, gliserin’de çözünür |
| Çözünürlük (asetik asit içinde) | 0.776 g/kg (30 °C) 1.244 g/kg (40 °C) 5.503 g/kg (93 °C)[2] |
| Çözünürlük (aseton içinde) | 0.35 g/100 g (14 °C) 0.44 g/100 g (18 °C)[3] |
| Çözünürlük (benzen içinde) | 0.22 g/kg (35 °C) 0.44 g/kg (40.5 °C)[3] |
| Çözünürlük (etanol içinde) | 3.1 g/100 g (19 °C)[3] |
| Çözünürlük (etil asetat içinde) | 2.7 g/100 g (20 °C)[2] |
| log P | 0.19 |
| −45.7•10−6 cm3/mol | |
| Kırınım dizimi (nD) | 1.744 |
| Akmazlık | 3.77 cP (244 °C) 3.04 cP (275 °C)[2] |
| Yapı | |
| Ortorombik, oP56[4] | |
| Termokimya | |
Isı sığası (C) | 93.1 J/mol•K[1] |
Standart molar entropi (S⦵298) | 140.9 J/mol•K[1] |
Standart formasyon entalpisi (ΔfH⦵298) | −124.4 kJ/mol[1] |
Gibbs serbest enerjisi (ΔfG⦵) | −33.4 kJ/mol[1] |
| Farmakoloji | |
| D08AL01 (DSÖ) | |
| Tehlikeler | |
| İş sağlığı ve güvenliği (OHS/OSH): | |
| Ana tehlikeler | Etanol ile patlayıcı reaksiyona girer. Toksik. Aşındırıcı. |
| GHS etiketleme sistemi: | |
| Piktogramlar |     [5] [5] |
| İşaret sözcüğü | Tehlike |
| Tehlike ifadeleri | H272, H314, H410[5] |
| Önlem ifadeleri | P220, P273, P280, P305+P351+P338, P310, P501[5] |
| NFPA 704 (yangın karosu) | |
| Öldürücü doz veya konsantrasyon (LD, LC): | |
LDLo (yayınlanan en düşük) | 800 mg/kg (tavşan, oral) 20 mg/kg (köpek, oral)[6] |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |
Gümüş nitrat en önemli gümüş tuzudur. Renksiz ağır kristallerden oluşur . Tıpta dağlamak maksadıyla kullanılır ve antibakteriyel özelliği vardır. Bu özelliğinden dolayı siğil tedavisinde sıkça kullanılır. Ayrıca deriyi ve organik maddeleri karartmada tercih edilir. Deriyi kararttığından cehennem taşı ismini almıştır. Suda ve alkolde kolayca çözündüğünden birçok gümüş bileşiklerinin elde edilmesinde ilkel madde olarak kullanılır. En çok kullanıldığı yerler, başta fotoğrafçılık olmak üzere mürekkepler, saç boyası yapımı ve gümüş kaplamacılığıdır.bileşenleri gümüş ve nitrik asittir. Sentezi ise örnekteki formüle göre yapılır:
- Ag + 2 HNO3 → AgNO3 + NO2 + H2O
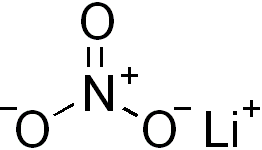
Nitrat, (kim. formülü: NO3−), kimyada bir azot ve üç oksijen atomundan oluşan bir nitrik asit (kim. formülü: HNO3) tuzu iyonudur. Organik kimyada, nitrik asit ve bazı alkollerin esterlerine nitrat adı verilir. Moleküler ağırlığı 62.0049'dir. Moleküler geometrisi düzlem üçgendir ve oksijen atomları arasındaki açı 120 derecedir.
Kaynakça
- ^ a b c d e f g h Lide, David R., (Ed.) (2009). CRC Handbook of Chemistry and Physics (90th bas.). Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ^ a b c d Kiper, Ruslan Anatolievich. "silver nitrate". Chemister.ru. 11 Ağustos 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 20 Temmuz 2014.
- ^ a b c d Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (2. bas.). New York: D. Van Nostrand Company. ss. 617-619.
- ^ Kaynak hatası: Geçersiz
<ref>etiketi;iucrisimli refler için metin sağlanmadı (Bkz: ) - ^ a b c Sigma-Aldrich Co., Gümüş nitrat. Retrieved on 20 Temmuz 2014.
- ^ "Gümüş (metal tozu ve çözünür bileşikler)". Immediately Dangerous to Life or Health Concentrations (IDLH). Ulusal İş Sağlığı ve Güvenliği Enstitüsü (NIOSH).
Dış bağlantılar
- International Chemical Safety Card 1116 20 Ocak 2018 tarihinde Wayback Machine sitesinde arşivlendi.
- NIOSH Pocket Guide to Chemical Hazards 21 Şubat 2011 tarihinde Wayback Machine sitesinde arşivlendi.
| HNO3 | He | ||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO3)-4 | RONO2 | NO-3 NH4NO3 | HOONO2 | FNO3 | Ne | ||||||||||
| NaNO3 | Mg(NO3)2 | Al(NO3)3 | Si | P | S | ClONO2 | Ar | ||||||||||
| KNO3 | Ca(NO3)2 | Sc(NO3)3 | Ti(NO3)4 | VO(NO3)3 | Cr(NO3)3 | Mn(NO3)2 | Fe(NO3)2 Fe(NO3)3 | Co(NO3)2 Co(NO3)3 | Ni(NO3)2 | CuNO3 Cu(NO3)2 | Zn(NO3)2 | Ga(NO3)3 | Ge | As | Se | BrNO3 | Kr |
| RbNO3 | Sr(NO3)2 | Y(NO3)3 | Zr(NO3)4 | Nb | Mo | Tc | Ru(NO3)3 | Rh(NO3)3 | Pd(NO3)2 Pd(NO3)4 | AgNO3 Ag(NO3)2 | Cd(NO3)2 | In(NO3)3 | Sn(NO3)4 | Sb(NO3)3 | Te | INO3 | Xe(NO3)2 |
| CsNO3 | Ba(NO3)2 | Hf(NO3)4 | Ta | W | Re | Os | Ir | Pt(NO3)2 Pt(NO3)4 | Au(NO3)3 | Hg2(NO3)2 Hg(NO3)2 | TlNO3 Tl(NO3)3 | Pb(NO3)2 | Bi(NO3)3 BiO(NO3) | Po(NO3)4 | At | Rn | |
| FrNO3 | Ra(NO3)2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| La(NO3)3 | Ce(NO3)3 Ce(NO3)4 | Pr(NO3)3 | Nd(NO3)3 | Pm(NO3)3 | Sm(NO3)3 | Eu(NO3)3 | Gd(NO3)3 | Tb(NO3)3 | Dy(NO3)3 | Ho(NO3)3 | Er(NO3)3 | Tm(NO3)3 | Yb(NO3)3 | Lu(NO3)3 | |||
| Ac(NO3)3 | Th(NO3)4 | PaO2(NO3)3 | UO2(NO3)2 | Np(NO3)4 | Pu(NO3)4 | Am(NO3)3 | Cm(NO3)3 | Bk(NO3)3 | Cf | Es | Fm | Md | No | Lr | |||