Fosforil klorür
 | |||
| |||
 | |||
| Adlandırmalar | |||
|---|---|---|---|
Tercih edilen IUPAC adı Fosforil triklorür[1] | |||
Diğer adlar
| |||
| Tanımlayıcılar | |||
CAS numarası | |||
3D model (JSmol) | |||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.030.030 | ||
| EC Numarası |
| ||
| 2272 | |||
PubChem CID | |||
| RTECS numarası |
| ||
| UNII | |||
| UN numarası | 1810 | ||
CompTox Bilgi Panosu (EPA) | |||
| |||
| |||
| Özellikler | |||
| Kimyasal formül | Cl3OP | ||
| Molekül kütlesi | 153,33 g mol−1 | ||
| Görünüm | dumanlı, renksiz sıvı | ||
| Koku | keskin, rutubet benzeri | ||
| Yoğunluk | 1,645 g/cm3, sıvı | ||
| Erime noktası | 125 °C (257 °F; 398 K) | ||
| Kaynama noktası | 1.058 °C (1.936 °F; 1.331 K) | ||
| Çözünürlük (su içinde) | tepkir | ||
| Çözünürlük | benzen, kloroform, karbon disülfür ve karbon tetraklorürde çözünür | ||
| Buhar basıncı | 40 mmHg (27 °C)[2] | ||
| Kırınım dizimi (nD) | 1.460 | ||
| Yapı | |||
| Fosfor atomundan Tetrahedral | |||
| Dipol momenti | 2.54 D | ||
| Termokimya[3] | |||
Isı sığası (C) | 138.8 J·mol−1·K−1 (sıvı), 84.9 J·mol−1·K−1 (gaz) | ||
Standart molar entropi (S⦵298) | 222.5 J·mol−1·K−1 (sıvı), 325.5 J·mol−1·K−1 (gaz) | ||
Standart formasyon entalpisi (ΔfH⦵298) | −597.1 kJ·mol−1 (sıvı), −558.5 kJ·mol−1 (gaz) | ||
Gibbs serbest enerjisi (ΔfG⦵) | −520.8 kJ·mol−1 (sıvı), −512.9 kJ·mol−1(gaz) | ||
Füzyon entalpisi (ΔfH⦵fus) | 13.1 kJ·mol−1 | ||
Buharlaşma entalpisi (ΔfHvap) | 38.6 kJ·mol−1 | ||
| Tehlikeler | |||
| İş sağlığı ve güvenliği (OHS/OSH): | |||
| Ana tehlikeler | Zehirli ve aşındırıcı[2] | ||
| GHS etiketleme sistemi: | |||
| Piktogramlar |     | ||
| İşaret sözcüğü | Danger | ||
| Tehlike ifadeleri | H302, H314, H330, H372 | ||
| Önlem ifadeleri | P260, P264, P270, P271, P280, P284, P301+P312, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P314, P320, P321, P330, P363, P403+P233, P405, P501 | ||
| NFPA 704 (yangın karosu) | |||
| Öldürücü doz veya konsantrasyon (LD, LC): | |||
LD50 (medyan doz) | 380 mg/kg (rat, oral) | ||
| NIOSH ABD maruz kalma limitleri: | |||
| PEL (izin verilen) | none[2] | ||
| REL (tavsiye edilen) | TWA 0.1 ppm (0.6 mg/m3) ST 0.5 ppm (3 mg/m3)[2] | ||
| IDLH (anında tehlike) | N.D.[2] | ||
| Güvenlik bilgi formu (SDS) | ICSC 0190 | ||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |||
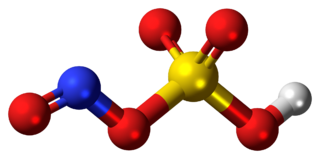
Fosforil klorür (genellikle fosfor oksiklorür olarak adlandırılır), POCl
3 formülüne sahip bir sıvıdır. Nemli havada hidrolize olup fosforik asit ve hidrojen klorür dumanı açığa çıkarır. Endüstriyel olarak büyük ölçekte fosfor triklorür ve oksijen veya fosfor pentoksitten üretilir.[4] Esas olarak fosfat esterleri yapmak için kullanılır.
Yapı

Fosfat gibi, POCl
3 tetrahedral şeklindedir.[6] Tahminî bağ ayrışma enerjisi 533,5 kJ/mol olan üç P−Cl bağı ve bir güçlü P–O bağı içerir. POF
3 durumundan farklı olarak, Schomaker-Stevenson kuralı, P–O bağı için uygun bağ uzunluğunu yalnızca P–O bağının çift bağ olarak ele alınması durumunda (P=O) öngörür.

Kristal yapısındaki ortalama bağ uzunlukları P–Cl arası 1,98 Å ve P=O için ise 1,46 Å'dür.[5]
Fiziksel özellikleri
3,4 atm kritik basınca sahiptir.[7] Donma noktası 1 °C ve kaynama noktası 106 °C olan POCl
3'ün sıvı aralığı suya oldukça benzer. Ayrıca su gibi POCl
3 de tersinir oluşumu nedeniyle [POCl
2]+
(diklorooksofosfonyum) katyonu ve Cl−
anyonlarınaotoiyonize olur.
Kimyasal özellikler
POCl
3 suyla tepkimeye girerek hidrojen klorür ve fosforik asit verir:
- O=PCl
3 + 3 H
2O → O=P(OH)
3 + 3 HCl
Pirofosforil klorür O(−P(=O)Cl
2)
2 de dâhil olmak üzere dönüşümdeki ara maddeler izole edilmiştir.[8]
Fazla alkol ve fenollerle muamele üzerine, POCl
3 onların fosfat esterlerini verir:
- O=PCl
3 + 3 ROH → O=P(OR)
3 + 3 HCl
Bu tür reaksiyonlar sıklıkla piridin veya bir amin gibi bir HCl alıcısının varlığında gerçekleştirilir.
Alüminyum klorür kompleksi (POCl
3·AlCl
3 ) oldukça kararlıdır ve bu nedenle (örneğin bir Friedel-Crafts reaksiyonunun sonunda) reaksiyon karışımlarından POCl
3 çıkarmak için kullanılabilir.
Hazırlanması
Fosforil klorür birçok yöntemle hazırlanabilir. Fosforil klorür ilk olarak 1847'de Fransız kimyager Adolphe Wurtz tarafından fosfor pentaklorürün suyla reaksiyona sokulmasıyla elde edildi.[9]
Oksidasyon ile
Ticari yöntem, fosfor triklorürün oksijenle oksidasyonunu içerir:
- 2 PCl
3 + O
2 → 2 POCl
3
Alternatif bir yöntem, fosfor triklorürün potasyum klorat ile oksidasyonunu içerir:[10]
- 3 PCl
3 + KClO
3 → 3 POCl
3 + KCl
Oksijenasyonlar
Fosfor pentaklorürün fosfor pentoksit ile reaksiyonu:
- 6 PCl
5 + P
4O
10 → 10 POCl
3
Diğer yöntemler
Klor gazı varlığında trikalsiyum fosfatın karbonla indirgenmesi:[11]
- Ca
3(PO
4)
2 + 6 C + 6 Cl
2 → 3 CaCl
2 + 6 CO + 2 POCl
3
Fosfor pentoksidin sodyum klorür ile reaksiyonu da fosforil klorür verebilir:[11]
- 2 P
2O
5 + 3 NaCl → 3 NaPO
3 + POCl
3
Kullanım alanları
Fosforil klorür, fosfat esterlerinin (organofosfatlar) üretimi için endüstriyel ölçekte kullanılır. Bunlar, alev geciktiriciler (bisfenol A difenil fosfat, TCPP ve trikresil fosfat), PVC ve ilgili polimerler için plastikleştiriciler (2-etilheksil difenil fosfat) ve hidrolik sıvılar dahil olmak üzere geniş bir kullanım alanına sahiptir. POCl3 ayrıca organofosfat insektisitlerin üretiminde de kullanılır.
Yarı iletken endüstrisinde POCl
3 difüzyon proseslerinde güvenli bir sıvı fosfor kaynağı olarak kullanılır. Fosfor, silikon levha üzerinde katmanlar oluşturmak için kullanılan bir katkı maddesi görevi görür.
Reaktif olarak
Laboratuvarda, POCl
3 dehidrasyonlarda bir reaktif görevi görür. Bir örnek, formamidlerin izonitrillere (izosiyanürler) dönüştürülmesini içerir;[12] birincil amidlerden nitrillere:[13]
- RC(O)NH
2 + POCl
3 → RCN + P(O)OHCl + 2 HCl
İlgili bir reaksiyonda, bazı aril ikameli amidler Bischler-Napieralski reaksiyonu kullanılarak halkaya dönüştürülebilir.
Bu tür reaksiyonların bir imidoil klorür yoluyla ilerlediğine inanılmaktadır. Bazı durumlarda imidoil klorür nihai üründür. Örneğin piridonlar ve pirimidonlar, ilaç endüstrisinde ara ürünler olan 2-kloropiridinler ve 2-kloropirimidinler gibi kloro-türevlerine dönüştürülebilir.[14]
Vilsmeier-Haack reaksiyonunda POCl
3 amidlerle reaksiyona girerek bir "Vilsmeier reaktifi", bir kloro-iminyum tuzu üretir ve bu daha sonra sulu işlem sonrasında aromatik aldehitler üretmek üzere elektron açısından zengin aromatik bileşiklerle reaksiyona girer.[15]
Kaynakça
- ^ Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. s. 926. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ a b c d e NIOSH Pocket Guide to Chemical Hazards. "#0508". National Institute for Occupational Safety and Health (NIOSH).
- ^ CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data. 2016-2017, 97th. William M. Haynes, David R. Lide, Thomas J. Bruno. Boca Raton, Florida. 2016. ISBN 978-1-4987-5428-6. OCLC 930681942.
- ^ Toy, Arthur D. F. (1973). The Chemistry of Phosphorus. Oxford: Pergamon Press. ISBN 978-0-08-018780-8. OCLC 152398514.
- ^ a b Olie, K. (1971). "The crystal structure of POCl3". Acta Crystallogr. B. 27 (7): 1459-1460. doi:10.1107/S0567740871004138.
- ^ Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements. 2nd. Oxford: Butterworth-Heinemann.
- ^ "Phosphoryl chloride".
- ^ Grunze, Herbert (1963). "Über die Hydratationsprodukte des Phosphoroxychlorides. III. Darstellung von Pyrophosphorylchlorid aus partiell hydrolysiertem Phosphoroxychlorid (Hydration products of phosphorus oxychloride. III. Preparation of pyrophosphoryl chloride from partially hydrolyzed phosphorus oxychloride)". Zeitschrift für Anorganische und Allgemeine Chemie. 324: 1-14. doi:10.1002/zaac.19633240102.
- ^ Wurtz, Adolphe (1847). "Sur l'acide sulfophosphorique et le chloroxyde de phosphore" [On monothiophosphoric acid and phosphoryl chloride]. Annales de Chimie et de Physique. 3rd series (Fransızca). 20: 472-481. 18 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 19 Temmuz 2024.
- ^ Pradyot, Patnaik (2003). Handbook of Inorganic Chemicals. New York: McGraw-Hill. s. 709. ISBN 0-07-049439-8.
- ^ a b Lerner, Leonid (2011). Small-Scale Synthesis of Laboratory Reagents with Reaction Modeling. Boca Raton, Florida: CRC Press. ss. 169-177. ISBN 978-1-4398-1312-6.
- ^ Patil, Pravin; Ahmadian-Moghaddam, Maryam; Dömling, Alexander (29 Eylül 2020). "Isocyanide 2.0". Green Chemistry. 22 (20): 6902-6911. doi:10.1039/D0GC02722G.
- ^ March, J. (1992). Advanced Organic Chemistry. 4th. New York, NY: Wiley. s. 723. ISBN 978-0-471-60180-7.
- ^ Elderfield, R. C. ((Ed.)). Heterocyclic Compound. 6. New York, NY: John Wiley & Sons. s. 265.
- ^ Hurd, Charles D.; Webb, Carl N. (1925). "p-Dimethylaminobenzophenone". Organic Syntheses. 7: 24. doi:10.15227/orgsyn.007.0024.