Fosfomisin
 | |
 | |
| Klinik verisi | |
|---|---|
| Ticari adlar | Monuril, Monurol, Ivozfo, diğerleri |
| Diğer adlar | Fosfomisin, fosfonomisin, fosfomisin trometamin |
| AHFS/Drugs.com | Monografi |
| MedlinePlus | a697008 |
| Lisans veri |
|
| Uygulama yolu | İntravenöz, oral uygulama |
| ATC kodu | |
| Hukuki durum | |
| Hukuki durum |
|
| Farmakokinetik veri | |
| Biyoyararlanım | %30-37 (ağız yoluyla, fosfomisin trometamin); gıda alımına göre değişir |
| Protein bağlanma | Nil |
| Metabolizma | Nil |
| Eliminasyon yarı ömrü | 5,7 saat (ortalama) |
| Boşaltım | Böbrek, değişmemiş |
| Tanımlayıcılar | |
| |
| CAS Numarası |
|
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| CompTox Bilgi Paneli (EPA) | |
| ECHA Bilgi Kartı | 100.041.315 |
| Kimyasal ve fiziksel veriler | |
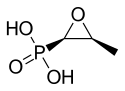
| Formül | C3H7O4P |
| Mol kütlesi | 138,059 g·mol−1 |
| 3D model (JSmol) | |
| Erime noktası | 94 °C (201 °F) |
| |
| |
Diğerlerinin yanı sıra Monurol markası altında satılan fosfomisin, öncelikle alt idrar yolu enfeksiyonlarını tedavi etmek için kullanılan bir antibiyotiktir.[6] Böbrek enfeksiyonları için endike değildir.[6] Nadiren prostat enfeksiyonları için kullanılır.[6] Genellikle ağız yoluyla alınır.[6]
Yaygın yan etkiler arasında ishal, bulantı, baş ağrısı ve vajinal mantar enfeksiyonları yer alır.[6] Ciddi yan etkiler arasında anafilaksi ve Clostridioides difficile ile ilişkili ishal sayılabilir.[6] Hamilelik sırasında kullanımın zararlı olduğu tespit edilmemiş olsa da bu tür bir kullanım önerilmemektedir.[7] Emzirme döneminde tek bir doz güvenli görünmektedir.[7] Fosfomisin, bakteri hücre duvarının üretimine müdahale ederek çalışır.[6]
Fosfomisin 1969 yılında keşfedilmiş ve 1996 yılında Amerika Birleşik Devletleri'nde tıbbi kullanım için onaylanmıştır.[6][8] Dünya Sağlık Örgütünün Temel İlaçlar Listesi'nde yer almaktadır.[9] Dünya Sağlık Örgütü fosfomisini insan tıbbı için kritik öneme sahip olarak sınıflandırmaktadır.[10] Jenerik bir ilaç olarak mevcuttur.[11] Orijinal olarak belirli Streptomyces türleri tarafından üretilmiştir, ancak artık kimyasal olarak üretilmektedir.[8]
Tıbbi kullanımlar
Fosfomisin, genellikle ağız yoluyla tek doz olarak verildiği mesane enfeksiyonlarını tedavi etmek için kullanılır.[12]
Oral fosfomisin 12 yaşın altındaki çocuklar için önerilmez.[13]
Ek kullanım alanları önerilmiştir.[14] Antimikrobiyal direncin ilerlemesine ilişkin küresel sorun, son zamanlarda kullanımına yönelik ilginin yeniden artmasına yol açmıştır.[15]
Fosfomisin hem İYE'ler hem de akut piyelonefrit dahil komplike İYE'ler için etkili bir tedavi olarak kullanılabilir. Komplike İYE'ler için standart rejim, toplam 3 doz boyunca her 48 veya 72 saatte bir uygulanan oral 3 g doz veya fosfomisin IV formda verildiğinde 7-14 gün boyunca her 8 saatte bir 6 g dozdur.[16]
İntravenöz fosfomisin, çoklu ilaca dirençli bakterilerin neden olduğu enfeksiyonların tedavisinde, direnç oluşumunu önlemek ve diğer birçok antimikrobiyal ile sinerjik aktivitesinden yararlanmak için çoğunlukla ortak ilaç olarak giderek daha fazla kullanılmaktadır. Günlük yetişkin dozu genellikle 12 ila 24 gram arasında değişir.[17] Sürekli infüzyon halinde uygulandığında, 8 g fosfomisin yükleme dozunu takiben 16 g veya 24 g günlük doz uygulanır. Normal böbrek fonksiyonu olan hastalarda sürekli infüzyon önerilir.[18]
Bakteriyel duyarlılık
Fosfomisin molekülü, oldukça gergin ve dolayısıyla çok reaktif olan bir epoksit veya oksiran halkasına sahiptir.[]
Fosfomisin, E. faecalis, E. coli ve Citrobacter ve Proteus gibi çeşitli Gram-negatiflere karşı yararlı aktivite ile hem Gram-pozitif hem de Gram-negatif patojenlere karşı geniş antibakteriyel aktiviteye sahiptir. Düşük pH ortamında daha fazla aktivite göstermesi ve idrarla aktif formda atılımının baskın olması nedeniyle fosfomisin, bu üropatojenlerin neden olduğu İYE'lerin profilaksisi ve tedavisinde kullanım alanı bulmuştur. S. saprophyticus, Klebsiella ve Enterobacter'e karşı aktivite değişkendir ve minimum inhibitör konsantrasyon testi ile doğrulanmalıdır. Genişlemiş spektrumlu β-laktamaz üreten patojenlere, özellikle de ESBL üreten E. coli'ye karşı aktivite iyi ila mükemmeldir, çünkü ilaç çapraz direnç sorunlarından etkilenmez. Mevcut klinik veriler, duyarlı organizmaların neden olduğu komplike olmayan İYE'lerde kullanımı desteklemektedir. Bununla birlikte, 64 mg/L'lik duyarlılık kırılma noktaları sistemik enfeksiyonlar için uygulanmamalıdır.[]
Direnç
Tedavi altında bakteriyel direnç gelişimi sık görülen bir durumdur ve fosfomisini ciddi enfeksiyonların sürekli tedavisi için uygunsuz hale getirir. Gerekli olmayan gliserofosfat taşıyıcısını inaktive eden mutasyonlar bakterileri fosfomisine dirençli hale getirir.[19][20][21]
Fosfomisinin en az başka bir aktif ilaçla birlikte reçete edilmesi bakteriyel direnç gelişme riskini azaltır. Fosfomisin, aminoglikozidler, karbapenemler, sefalosporinler, daptomisin ve oritavansin dahil olmak üzere diğer birçok antibiyotikle sinerjik olarak etki eder.[17][22]
Fosfomisine direnç kazandıran enzimler de tanımlanmıştır ve hem kromozomal olarak hem de plazmidler üzerinde kodlanmaktadır.[23]
Üç ilgili fosfomisin direnç enzimi (FosA, FosB ve FosX olarak adlandırılır) glioksalaz süper ailesinin üyeleridir. Bu enzimler fosfomisinin 1 numaralı karbonuna nükleofilik saldırıda bulunarak epoksit halkasını açar ve ilacı etkisiz hale getirir.[]
Enzimler, reaksiyonda kullanılan nükleofilin kimliğine göre farklılık gösterir: FosA için glutatyon, FosB için bakillitiol[24][25] ve FosX için su.[23]
Genel olarak, FosA ve FosX enzimleri Gram-negatif bakteriler tarafından üretilirken, FosB Gram-pozitif bakteriler tarafından üretilir.[23]
FosC ATP kullanır ve fosfomisine bir fosfat grubu ekler, böylece özelliklerini değiştirir ve ilacı etkisiz hale getirir.[26]
Yan etkiler
İlaç iyi tolere edilir ve zararlı yan etki insidansı düşüktür.[12]
Etki mekanizması
Adına rağmen (-omisin ile biten) Fosfomisin bir makrolid değil, yeni bir fosfonik antibiyotik sınıfının üyesidir. Fosfomisin bakterisidaldir ve MurA olarak da bilinen UDP-N-asetilglukozamin-3-enolpiruviltransferaz enzimini inaktive ederek bakteriyel hücre duvarı biyogenezini inhibe eder.[27] Bu enzim, peptidoglikan biyosentezinde, fosfoenolpiruvatın (PEP) UDP-N-asetilglukozaminin 3'-hidroksil grubuna bağlanması gibi kararlı bir adımı katalize eder. Bu piruvat parçası, peptidoglikanın glikan ve peptit kısmı arasında köprü kuran bağlayıcıyı sağlar. Fosfomisin, bir aktif bölge sistein kalıntısını (Escherichia coli enziminde Cys 115) alkilleyerek MurA'yı inhibe eden bir PEP analoğudur.[28][29]
Fosfomisin bakteri hücresine gliserofosfat taşıyıcısı yoluyla girer.[30]
Tarihçe
Fosfomisin (orijinal adıyla fosfonomisin) Merck & Co. ve İspanya'nın Compañía Española de Penicilina y Antibióticos (CEPA) şirketinin ortak çalışmasıyla keşfedilmiştir. İlk olarak, toprak örneklerinden izole edilen Streptomyces fradiae'nin broth kültürlerinin, büyüyen bakteriler tarafından sferoplast oluşumuna neden olma yeteneği açısından taranmasıyla izole edilmiştir. Bu keşif 1969 yılında yayınlanan bir dizi makalede açıklanmıştır.[31] CEPA, 1971 yılında Aranjuez tesisinde endüstriyel ölçekte fosfomisin üretmeye başlamıştır.[32]
Üretim
Streptomyces fradiae'den fosfomisin biyosentetik gen kümesinin tamamı klonlanıp dizilenmiş ve S. lividans'ta fosfomisinin heterolog üretimi Huimin Zhao ve Wilfred van der Donk araştırma gruplarından Ryan Woodyer tarafından gerçekleştirilmiştir.[33]
Fosfomisinin büyük ölçekli üretimi, rasemik karışım fosfomisin elde etmek için cis-propenilfosfonik asidin bir epoksitinin yapılmasıyla elde edilir.[34]
Kaynakça
- ^ "Prescription medicines: registration of new chemical entities in Australia, 2017". Therapeutic Goods Administration (TGA). 21 Haziran 2022. 10 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Nisan 2023.
- ^ "Regulatory Decision Summary - Ivozfo". Health Canada. 23 Ekim 2014. 7 Haziran 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Haziran 2022.
- ^ "Monuril 3g granules for oral solution - Summary of Product Characteristics (SmPC)". (emc). 1 Haziran 2021. 8 Mart 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Haziran 2022.
- ^ "Fomicyt 40 mg/mL powder for solution for infusion - Summary of Product Characteristics (SmPC)". (emc). 11 Şubat 2021. 7 Haziran 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Haziran 2022.
- ^ "Monurol- fosfomycin tromethamine powder". DailyMed. 24 Ekim 2019. 7 Haziran 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Haziran 2022.
- ^ a b c d e f g h "Fosfomycin Tromethamine Monograph for Professionals". Drugs.com (İngilizce). 29 Ekim 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Ekim 2019.
- ^ a b "Fosfomycin (Monurol) Use During Pregnancy". Drugs.com (İngilizce). 29 Ekim 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Ekim 2019.
- ^ a b Finch RG, Greenwood D, Whitley RJ, Norrby SR (2010). Antibiotic and Chemotherapy E-Book (İngilizce). Elsevier Health Sciences. s. 259. ISBN 9780702047657.
- ^ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Cenevre: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ World Health Organization (2019). Critically important antimicrobials for human medicine. 6th revision. Cenevre: World Health Organization. hdl:10665/312266. ISBN 9789241515528.
- ^ British national formulary : BNF 76. 76. Pharmaceutical Press. 2018. ss. 560-561. ISBN 9780857113382.
- ^ a b Patel SS, Balfour JA, Bryson HM (April 1997). "Fosfomycin tromethamine. A review of its antibacterial activity, pharmacokinetic properties and therapeutic efficacy as a single-dose oral treatment for acute uncomplicated lower urinary tract infections". Drugs. 53 (4). ss. 637-656. doi:10.2165/00003495-199753040-00007. PMID 9098664.
- ^ "MONURIL SACHETS 3G". 28 Mayıs 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Mayıs 2014.
- ^ Falagas ME, Giannopoulou KP, Kokolakis GN, Rafailidis PI (April 2008). "Fosfomycin: use beyond urinary tract and gastrointestinal infections". Clinical Infectious Diseases. 46 (7). ss. 1069-1077. doi:10.1086/527442. PMID 18444827.
- ^ Falagas ME, Grammatikos AP, Michalopoulos A (October 2008). "Potential of old-generation antibiotics to address current need for new antibiotics". Expert Review of Anti-Infective Therapy. 6 (5). ss. 593-600. doi:10.1586/14787210.6.5.593. PMID 18847400.
- ^ Zhanel GG, Zhanel MA, Karlowsky JA (28 Mart 2020). "Oral and Intravenous Fosfomycin for the Treatment of Complicated Urinary Tract Infections". The Canadian Journal of Infectious Diseases & Medical Microbiology. Cilt 2020. Hindawi Limited. s. 8513405. doi:10.1155/2020/8513405. PMC 7142339 $2. PMID 32300381.
- ^ a b Antonello RM, Principe L, Maraolo AE, Viaggi V, Pol R, Fabbiani M, ve diğerleri. (August 2020). "Fosfomycin as Partner Drug for Systemic Infection Management. A Systematic Review of Its Synergistic Properties from In Vitro and In Vivo Studies". Antibiotics. 9 (8). s. 500. doi:10.3390/antibiotics9080500. PMC 7460049 $2. PMID 32785114.
- ^ Antonello RM, Di Bella S, Maraolo AE, Luzzati R (June 2021). "Fosfomycin in continuous or prolonged infusion for systemic bacterial infections: a systematic review of its dosing regimen proposal from in vitro, in vivo and clinical studies". European Journal of Clinical Microbiology & Infectious Diseases. 40 (6). ss. 1117-1126. doi:10.1007/s10096-021-04181-x. PMC 8139892 $2. PMID 33604721.
- ^ Kahan FM, Kahan JS, Cassidy PJ, Kropp H (May 1974). "The mechanism of action of fosfomycin (phosphonomycin)". Annals of the New York Academy of Sciences. 235 (1). ss. 364-386. Bibcode:1974NYASA.235..364K. doi:10.1111/j.1749-6632.1974.tb43277.x. PMID 4605290.
- ^ Castañeda-García A, Blázquez J, Rodríguez-Rojas A (April 2013). "Molecular Mechanisms and Clinical Impact of Acquired and Intrinsic Fosfomycin Resistance". Antibiotics. 2 (2). ss. 217-236. doi:10.3390/antibiotics2020217. PMC 4790336 $2. PMID 27029300.
- ^ Lagatolla C, Mehat JW, La Ragione RM, Luzzati R, Di Bella S (September 2022). "In Vitro and In Vivo Studies of Oritavancin and Fosfomycin Synergism against Vancomycin-Resistant Enterococcus faecium". Antibiotics. 11 (10). s. 1334. doi:10.3390/antibiotics11101334. PMC 9598191 $2. PMID 36289992.
- ^ a b c Rigsby RE, Fillgrove KL, Beihoffer LA, Armstrong RN (2005). "Fosfomycin resistance proteins: a nexus of glutathione transferases and epoxide hydrolases in a metalloenzyme superfamily". Gluthione [sic] Transferases and Gamma-Glutamyl Transpeptidases. Methods in Enzymology. 401. ss. 367-379. doi:10.1016/S0076-6879(05)01023-2. ISBN 9780121828066. PMID 16399398.
- ^ Sharma SV, Jothivasan VK, Newton GL, Upton H, Wakabayashi JI, Kane MG, ve diğerleri. (July 2011). "Chemical and Chemoenzymatic syntheses of bacillithiol: a unique low-molecular-weight thiol amongst low G + C Gram-positive bacteria". Angewandte Chemie. 50 (31). ss. 7101-7104. doi:10.1002/anie.201100196. PMID 21751306.
- ^ Roberts AA, Sharma SV, Strankman AW, Duran SR, Rawat M, Hamilton CJ (April 2013). "Mechanistic studies of FosB: a divalent-metal-dependent bacillithiol-S-transferase that mediates fosfomycin resistance in Staphylococcus aureus". The Biochemical Journal. 451 (1). ss. 69-79. doi:10.1042/BJ20121541. PMC 3960972 $2. PMID 23256780.
- ^ García P, Arca P, Evaristo Suárez J (July 1995). "Product of fosC, a gene from Pseudomonas syringae, mediates fosfomycin resistance by using ATP as cosubstrate". Antimicrobial Agents and Chemotherapy. 39 (7). ss. 1569-1573. doi:10.1128/aac.39.7.1569. PMC 162783 $2. PMID 7492106.
- ^ Brown ED, Vivas EI, Walsh CT, Kolter R (July 1995). "MurA (MurZ), the enzyme that catalyzes the first committed step in peptidoglycan biosynthesis, is essential in Escherichia coli". Journal of Bacteriology. 177 (14). ss. 4194-4197. doi:10.1128/jb.177.14.4194-4197.1995. PMC 177162 $2. PMID 7608103.
- ^ Zhu JY, Yang Y, Han H, Betzi S, Olesen SH, Marsilio F, Schönbrunn E (April 2012). "Functional consequence of covalent reaction of phosphoenolpyruvate with UDP-N-acetylglucosamine 1-carboxyvinyltransferase (MurA)". The Journal of Biological Chemistry. 287 (16). ss. 12657-12667. doi:10.1074/jbc.M112.342725. PMC 3339971 $2. PMID 22378791.
- ^ Krekel F, Samland AK, Macheroux P, Amrhein N, Evans JN (October 2000). "Determination of the pKa value of C115 in MurA (UDP-N-acetylglucosamine enolpyruvyltransferase) from Enterobacter cloacae". Biochemistry. 39 (41). ss. 12671-12677. doi:10.1021/bi001310x. PMID 11027147.
- ^ Santoro A, Cappello AR, Madeo M, Martello E, Iacopetta D, Dolce V (December 2011). "Interaction of fosfomycin with the glycerol 3-phosphate transporter of Escherichia coli". Biochimica et Biophysica Acta (BBA) - General Subjects. 1810 (12). ss. 1323-1329. doi:10.1016/j.bbagen.2011.07.006. PMID 21791237.
- ^ Silver LL (2011). "Rational Approaches to Antibacterial Discovery: Pre-Genomic Directed and Phenotypic Screening". Dougherty T, Pucci MJ (Ed.). Antibiotic Discovery and Development. Springer. s. 46. doi:10.1007/978-1-4614-1400-1_2. ISBN 978-1-4614-1400-1.
- ^ "About us: Our history". Encros. 14 Eylül 2011 tarihinde kaynağından arşivlendi.
- ^ Woodyer RD, Shao Z, Thomas PM, Kelleher NL, Blodgett JA, Metcalf WW, ve diğerleri. (November 2006). "Heterologous production of fosfomycin and identification of the minimal biosynthetic gene cluster". Chemistry & Biology. 13 (11). ss. 1171-1182. doi:10.1016/j.chembiol.2006.09.007. PMID 17113999.
- ^ Marocco CP, Davis EV, Finnell JE, Nguyen PH, Mateer SC, Ghiviriga I, ve diğerleri. (2011). "Asymmetric synthesis of (−)-fosfomycin and its trans-(1S,2S)-diastereomer using a biocatalytic reduction as the key step". Tetrahedron: Asymmetry. 22 (18–19). Elsevier BV. ss. 1784-1789. doi:10.1016/j.tetasy.2011.10.009. ISSN 0957-4166.
Dış bağlantılar
- "Fosfomycin". Drug Information Portal. U.S. National Library of Medicine. 18 Ağustos 2016 tarihinde kaynağından arşivlendi.