
Karboksilik asitler karboksil grubu olan organik asitlerdir, -C(=O)OH formülüne sahiptirler, bu genelde -COOH veya CO2H olarak da yazılır. Karboksilik asitler Bronsted asitleridir, yani proton vericileridir. Karboksilik asitlerin tuz ve anyonlarına karboksilat denir. Karboksilik asitler, esterlerle fonsiyonel grup izomeridirler. Karboksilik asitlerin en basit dizisi alkanoik asitlerdir, R-COOH formülüyle gösterilirler, R bir hidrojen atomu veya bir alkil grubuna karşılık gelir. Bileşiklerde birden fazla karboksilik asit grubu bulunabilir.
Nitrik asit, HNO3 kimyasal formülüne sahip oldukça aşındırıcı bir inorganik asittir. Kezzap olarak da bilinir. Saf hâldeki bileşik renksizdir. Ancak uzun süre bekleyen eski asitler azot oksitleri ve suya ayrışması nedeniyle sarı renge dönebilme özelliğindedirler. Piyasada bulunan nitrik asitlerin çoğu % 68'lik bir konsantrasyona sahiptir. Çözelti, %86'dan fazla HNO3 içerdiğinde, dumanlı nitrik asit olarak adlandırılır. Mevcut azot dioksit miktarına bağlı olarak, dumanlı nitrik asit ayrıca %86’nın üzerindeki konsantrasyonlarda kırmızı dumanlı nitrik asit veya %95’in üzerindeki konsantrasyonlarda beyaz dumanlı nitrik asit olarak tanımlanır.

Klorik asit (HClO3), klorun bir oksoasiti ve klorat tuzlarının formal öncülüdür. Güçlü bir asit (pKa ≈1) ve oksitleyici ajandır.
Floroantimonik asit (HSbF6) hidrojen florür ve antimon pentaflorürün farklı oranlardaki karışımıdır. Bu karışımlardan 1:1 kombinasyonu, bilinen en güçlü süperasit formunu oluşturur. Öyle ki, bu form, hidrokarbonları iyonize ederek karbokatyonlar ve H2 oluşturabilmektedir.
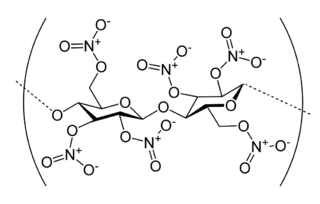
Nitroselüloz selülozun nitrik asite veya nitrik asit ve başka bir asit (genellikle hidroklorik asit veya sülfürik asit karışımına veyahut başka güçlü bir nitrolama maddesine maruz bırakılıp, nitrolanmayla oluşan oldukça yanıcı bir bileşiktir. İlk önemli kullanım alanlarından biri, ateşli silahlarda itici yakıt olarak barutun yerini alan pamuk barutu olarak kullanılmasıdır. Ayrıca madencilik ve diğer uygulamalarda barutun yerini alarak düşük güçte patlayıcı madde olarak kullanıldı.

İyot monoklorür ICl formülü ile gösterilen bir interhalojen bileşiktir. Oda sıcaklığına yakın eriyen kırmızı-kahverengi renge sahip bir kimyasal bileşiktir. İyot ve klorun elektronegatifliği arasındaki fark nedeniyle, ICl oldukça kutupsaldır ve I+ kaynağı olarak davranır.

Hipofloröz asit, kimyasal formül HOF, florun bilinen tek oksoasididir. Hipofloritlerde oksijenin oksidasyon durumu 0'dır. Aynı zamanda katı olarak izole edilebilen tek hipohaloid asittir. HOF, suyun, hidrojen florür, oksijen diflorür, hidrojen peroksit, ozon ve oksijen üreten flor ile oksidasyonunda bir ara maddedir. HOF oda sıcaklığında patlayıcıdır, HF ve O2 oluşturur:
- 2 HOF → 2 HF + O2
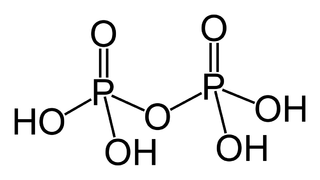
Difosforik asit olarak da bilinen pirofosforik asit, H4P2O7 formülüne sahip inorganik bir bileşik veya daha açıklayıcı olarak [(HO)2P(O)]2O'dur. Renksiz ve kokusuzdur, su, dietil eter ve etil alkolde çözünür. Susuz asit, 54.3 °C ve 71.5 °C'de eriyen iki polimorf içinde kristalleşir. Bileşik, polifosforik asit ve pirofosfat anyonunun konjugat asidinin bir bileşeni olması dışında özel olarak yararlı değildir. Pirofosforik asit anyonları, tuzları ve esterlerine pirofosfatlar denir.
Permanganik asit, HMnO4 formülüne sahip bir inorganik bileşiktir. Bu güçlü oksoasit, dihidrat olarak izole edilmiştir. Permanganat tuzlarının konjugat asididir. Çok az sayıda yayın konusu olup, karakterizasyonu ve kullanımları çok sınırlıdır.
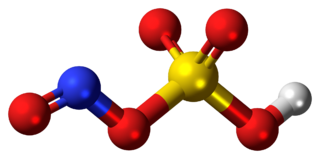
Nitrozilsülfürik asit, NOHSO4 formülüne sahip bir kimyasal bileşiktir. Endüstriyel olarak kaprolaktam üretiminde kullanılan renksiz bir katıdır. Daha önce sülfürik asit üretmek için öncü oda işleminin bir parçasıydı. Bileşik, sülfürik asit ve nitröz asidin karışık anhidritidir.

Kloroplatinik asit (hekzakloroplatinik asit olarak da bilinir), [H3O]2[PtCl6](H2O)x (0≤x≤6) formülüne sahip bir inorganik bileşiktir. Kırmızı bir katı, genellikle sulu bir çözelti olarak önemli bir platin kaynağıdır. Genellikle kısaca H2PtCl6 olarak yazılsa da, hekzakloroplatinat anyonunun (PtCl62-) hidronyum (H3O+) tuzudur. Hekzakloroplatinik asit oldukça higroskopiktir.

Hidrojen bromat olarak da bilinen bromik asit, HBrO3 moleküler formülüne sahip bir oksoasittir. Sadece sulu çözelti içinde bulunur. Broma ayrışırken oda sıcaklığında sarıya dönen renksiz bir çözeltidir. Bromik asit ve bromatlar güçlü oksitleyici ajanlardır ve Belousov-Zhabotinsky reaksiyonlarında yaygın bileşenlerdir. Belousov-Zhabotinsky reaksiyonları denge olmayan termodinamiğin klasik bir örneğidir.

İzosiyanik asit, 1830'da Liebig ve Wöhler tarafından keşfedilen HNCO formülüne sahip bir kimyasal bileşiktir. Kaynama noktası 23.5 °C olan uçucu ve zehirli renksiz bir maddedir. İzosiyanik asit, organik kimya ve biyolojide en yaygın olarak bulunan dört element olan karbon, hidrojen, azot ve oksijen içeren en basit kararlı kimyasal bileşiktir.

Sodyum bikromat Na2Cr2O7 formülüne sahip bir inorganik bileşiktir. Ancak, genellikle tuz dihidrat Na2Cr2O7•2H2O olarak kullanılır. Neredeyse tüm krom cevheri, sodyum bikromata dönüştürülerek işlenir ve neredeyse krom bazlı bütün bileşikler ve maddeler bu tuzdan hazırlanır. Reaktivite ve görünüm açısından, sodyum bikromat ve potasyum bikromat çok benzerdir. Bununla birlikte sodyum tuzu, suda potasyum tuzundan yaklaşık yirmi kat daha fazla çözünür(0 °C’de 49 g/L) ve eşdeğer ağırlığı da daha düşüktür ki bu da genellikle istenen bir durumdur.

Sodyum tiyosiyanat (bazen sodyum sülfosiyanür olarak da adlandırılır) NaSCN formülüne sahip kimyasal bileşiktir. Bu renksiz sulangan tuz tiyosiyanat anyonunun ana kaynaklarından biridir. Bu haliyle, ilaçların ve diğer özel kimyasal maddelerin sentezinde bir öncül madde olarak kullanılmaktadır. Tiyosiyanat tuzları tipik olarak siyanürün elementel kükürt ile olan reaksiyonuyla hazırlanır:
- 8 NaCN + S8 → 8 NaSCN
Sodyum triasetoksiborohidrür, yaygın olarak kısaca STAB olarak da bilinen sodyum triasetoksihidroborat, Na(CH3COO)3BH formülü sahip bir bileşiktir. Diğer borhidrürler gibi organik sentezlerde indirgeyici ajan olarak kullanılır. Bu renksiz tuz, sodyum borohidrürün asetik asit ile protonolizi ile hazırlanır:
- NaBH4 + 3 HO2CCH3 → NaBH(O2CCH3)3 + 3 H2
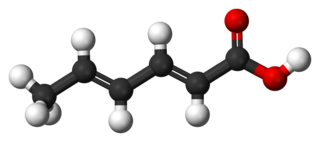
Sorbik asit veya 2,4-heksadienoik asit, gıda koruyucu olarak kullanılan doğal bir organik bileşik'tir. CH3(CH)4CO2H kimyasal formülüne sahiptir. Suda az çözünür ve kolayca süblimleşir renksiz bir katıdır. İlk olarak “Sorbus aucuparia”nın (üvez ağacının olgunlaşmamış meyvelerinden yalıtıldığından onun adını almıştır.

Triflorometansülfonik asit, (TFMS, TFSA, HOTf veya TfOH) veya kısaca triflik asit, CF3SO3H kimyasal formülüne sahip bir sülfonik asittir. Bilinen en güçlü asitlerden biridir. Triflik asit esas olarak araştırmalarda esterleşme için bir katalizör olarak kullanılır. Higroskopik, renksiz, biraz viskoz bir sıvıdır ve polar çözücülerde çözünür.

Trifenilfosfin, P(C
6H
5)
3 formülüne sahip yaygın bir organofosfor bileşiğidir ve sıklıkla PPh3 veya Ph3P olarak kısaltılır. Organik ve organometalik bileşiklerin sentezinde yaygın olarak kullanılır. PPh3, oda sıcaklığında nispeten havada stabil, renksiz kristaller hâlinde bulunur. Suda çözünmez ancak Benzen ve dietil eter gibi polar olmayan organik çözücülerde çözünür.

Maleik anhidrür, C2H2(CO)2O formüllü organik bir bileşiktir. Maleik asidin asit anhidrürüdür. Renksiz ya da beyaz bir katı olan bileşik, endüstriyel olarak üretilerek kaplama ve polimer alanlarında kullanılır.

















