Karbon, doğada yaygın bulunan ametal kimyasal elementtir. Evrende bolluk bakımından altıncı sırada yer alan karbon, kızgın yıldızlarda hidrojenin termonükleer yanmasında temel rol oynar. Dünyada hem doğal halde, hem de başka elementlerle bileşik halinde bulunan karbon, ağırlık olarak Dünya'nın yerkabuğunun yaklaşık %0,2'sini oluşturur. En arı (katışıksız) biçimleri elmas ve grafittir; daha düşük arılık derecelerinde maden kömürünün, kok kömürünün ve odun kömürünün bileşeni olarak bulunur. Atmosferin yaklaşık % 0,05'ini oluşturan ve bütün doğal sularda erimiş olarak bulunan karbon dioksit, kireç taşı ve mermer gibi karbonat mineralleri, kömürün, petrolün ve doğalgazın başlıca yapıtaşları olan hidrokarbonlar, en bol bulunan bileşikleridir.

Bütan, (ya da n-bütan) dört karbon atomu içeren dalsız bir bileşiktir: CH3CH2CH2CH3. İzobütan (i-bütan, 2-metilpropan) bütanın izomeridir, CH3CH(CH3)2. Normal şartlar altında bütan; aşırı yanıcı, renksiz ve kolay sıvılaşan bir gazdır.

Benzen, aren veya aromatik hidrokarbonlar olarak adlandırılan organik bileşikler sınıfının en basit üyesidir. Renksiz, yanıcı, kaynama noktası 80,1 °C, erime noktası 5,5 °C olan bir sıvıdır. Moleküler formülü C6H6'dır. Benzen, endüstriyel bakımdan değerli olduğu gibi yapısı bakımından da kimya çalışmalarında önemlidir. Kan hücrelerini öldürme etkisi olduğundan kanser yapıcı bileşikler arasına girer.

Naftalin veya naftalen, kapalı kimyasal formülü C10H8 olan, aromatik hidrokarbondur.

Asetilen (etin), bir tür hidrokarbondur. Üçlü bağ taşır ve formülü C2H2 şeklindedir. Alkin sınıfının ilk üyesidir.
Toluen tinerin karakteristik kokusuna sahip renksiz, suda çözünmeyen bir sıvıdır. Toluen, bir fenil grubuna bağlı CH3'ten oluşan mono-substituent benzen türevidir. Bundan dolayı toluenin IUPAC sistematik adı metil benzendir. Toluen bir aromatik hidrokarbondur. Ayrıca TNT (trinitrotoluen) patlayıcı madde yapımında kullanılır.

Formik asit, HCOOH, tek karbonlu karboksilik asittir. Metanoik asit olarak da bilinir. Formik asit, karbonil karbonuna bağlı alkil grubu içermemesiyle en basit karboksilli asit özelliği taşır. Hem aldehit hem de karboksilik asit özelliğine sahiptir.

Gümüş nitrat en önemli gümüş tuzudur. Renksiz ağır kristallerden oluşur. Tıpta dağlamak maksadıyla kullanılır ve antibakteriyel özelliği vardır. Bu özelliğinden dolayı siğil tedavisinde sıkça kullanılır. Ayrıca deriyi ve organik maddeleri karartmada tercih edilir. Deriyi kararttığından cehennem taşı ismini almıştır. Suda ve alkolde kolayca çözündüğünden birçok gümüş bileşiklerinin elde edilmesinde ilkel madde olarak kullanılır. En çok kullanıldığı yerler, başta fotoğrafçılık olmak üzere mürekkepler, saç boyası yapımı ve gümüş kaplamacılığıdır.bileşenleri gümüş ve nitrik asittir. Sentezi ise örnekteki formüle göre yapılır:
- Ag + 2 HNO3 → AgNO3 + NO2 + H2O

Organik kimyada bazı atom halkalarının yapısı beklenenin üstünde kararlıdır. Doymamış bağlar, yalın elektron çiftleri veya boş orbitallerden oluşan konjüge bir halkanın konjüge olmasından beklenecek kararlılıktan daha yüksek bir kararlılık gösterme özelliğine aromatiklik denir. Aromatiklik, halkasal delokalizasyon ve rezonansın bir belirtisi olarak da düşünülebilir.

Hidrokinon, benzen-1,4-diol ya da kuinol kimyasal formülü C6H4(OH)2 olan, fenol tipinde aromatik organik bileşiktir. Kimyasal yapısı bir benzen halkasına para konumda bağlı iki hidroksil grubundan oluşur. Beyaz granüler bir katıdır.

Siklohekzan; molekül formülü C6H12 olan, bir tane halka bulunduran sikloalkanlara dâhil olan bir bileşiktir. Siklohekzan renksiz, yanıcı bir sıvıdır. Çeşitli yollardan eldesi mümkündür. Siklohekzanın erime sıcaklığı 6,47 °C, kaynama sıcaklığı ise 80,74 °C'dir.

Azulen organik bir bileşiktir ve Naftalinin bir izomeridir. Naftalinin renksiz olmasına karşın, azulen koyu mavi bir renge sahiptir. İki terpenoid, vetivazulen (4,6-dimetil-2-izopropilazulen) ve guaiazulen (1,4-dimetil-7-izopropilazulen), bu özelliklere sahip azulen iskeletli maddeler, doğal olarak mantar pigmentlerinde, Peygamber ağacı yağında ve bazı deniz omugasızlarında bulunabilir.

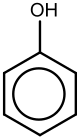
Organik kimya'da, fenoller ya da fenolikler, hidroksil grubunun (- O H ) doğrudan bir aromatik hidrokarbon grubuna bağlı olduğu bir grup kimyasal bileşiklerdir. Sınıfın en basiti fenoldür, C6H5OH. Fenolik bileşikler, moleküldeki fenol ünitelerinin sayısına bağlı olarak basit fenoller veya polifenoller olarak sınıflandırılır.

Piridin, C5H5N kimyasal formüllü, bazik bir heterosiklik organik bileşiktir. Yapısal olarak benzen ile ilişkilidir, bir metin grubu (=CH−) bir nitrojen atomu ile değiştirilir. Kendine özgü, hoş olmayan balık benzeri bir kokuya sahip, oldukça yanıcı, zayıf alkali, suda çözünür bir sıvıdır. Piridin renksizdir, ancak eski veya saf olmayan numuneler sarı renkte görünebilir. Piridin halkası, tarım kimyasalları, farmasötik ürünler ve vitaminler dahil olmak üzere birçok önemli bileşikte ortaya çıkar. Geçmişte piridin, kömür katranından üretilmiştir. Bugün dünya çapında yılda yaklaşık 20.000 ton ölçekte üretilmektedir.
Nitrolama bir nitro grubunun organik kimyasal bileşik içine sokulması için genel bir kimyasal proses sınıfıdır. İfade daha genel olarak, ayrıca nitrogliserin sentezinde olduğu gibi alkoller ve nitrik asit arasında farklı nitrat esterleri oluşturma işlemine yanlış olarak uygulanır. Nitro bileşiklerinin ve nitratların ortaya çıkan yapısı arasındaki fark nitro bileşiklerindeki azot atomunun doğrudan oksijen olmayan bir atoma genel olarak da karbon veya başka azot atomuna bağlanmasıdır. Oysaki organik nitratlar olarak da adlandırılan nitrat esterlerinde, azot bir oksijen atomuna genellikle dolayısıyla da bir karbon atomu 'na bağlanır.

4-Nitroanilin, p-nitroanilin veya 1-amino-4-nitrobenzen C6H6N2O2 formülüne sahip organik bir bileşiktir. Bir amino grubunun bir nitro grubuna tam karşısında para konumunda olduğu, bir benzen halkasından oluşan organik kimyasal bileşiktir. Bu kimyasal madde genellikle boyaların, antioksidanların, ilaçların, benzinin, yakıt artığı önleyicilerinin, kümes hayvanı ilaçlarının sentezinde bir ara madde olarak ve bir korozyon önleyici olarak kullanılır.

Nitrobenzen kimyasal formülü C6H5NO2 olan bir organik bileşiktir. Acıbadem benzeri bir kokuya sahip, suda çözünmeyen soluk sarı renkli bir yağdır. Donduğunda yeşilimsi sarı renkli kristallere dönüşür. Anilinin öncül maddesi olarak benzenden büyük ölçüde üretilir. Laboratuvarda, özellikle elektrofil reaktifler için, bazen bir çözücü olarak kullanılır.

4-Nitroklorobenzen ClC6H4NO2 formülüne sahip bir organik bileşiktir. Soluk sarı renkte bir katıdır. 4-Nitroklorobenzen, lastikte bulunan yaygın antioksidanlar da dahil olmak üzere endüstriyel olarak kullanılan bir dizi bileşiğin üretiminde yaygın bir ara maddedir. ClC6H4NO2 formülüne sahip diğer izomerler arasında 2-nitroklorobenzen ve 3-nitroklorobenzen bulunur.

Klorobenzen, C
6H
5Cl kimyasal formülüne sahip aromatik bir organik bileşiktir. Bu renksiz, yanıcı sıvı, yaygın bir çözücüdür ve diğer kimyasalların üretiminde yaygın olarak kullanılan bir ara maddedir.
Morfolin, O(CH
2CH
2)
2NH kimyasal formülüne sahip organik bir kimyasal bileşiktir. Bu halkalı bileşik, hem amin hem de eter fonksiyonel grupları içerir. Amin nedeniyle morfolin bir bazdır; konjuge asidine morfolinyum denir. Örneğin, morfolinin hidroklorik asitle işlenmesi, morfolinyum klorür tuzunu oluşturur. Zayıf, amonyak veya balık benzeri bir kokuya sahip, renksiz bir sıvıdır. Morfolinin adlandırılması, onun morfinin yapısının bir parçası olduğuna inanan Ludwig Knorr'a atfedilir.



 [5]
[5]