
Hidrojen, sembolü H, atom numarası 1 olan kimyasal bir element. Standart sıcaklık ve basınç altında renksiz, kokusuz, metalik olmayan, tatsız, oldukça yanıcı ve H2 olarak bulunan bir diatomik gazdır. 1,00794 g/mol'lük atomik kütlesi ile tüm elementler arasında en hafif olanıdır. Periyodik cetvelin sol üst köşesinde yer alır. Hidrojenin adı, Yunancada "su oluşturan" anlamına gelen ὑδρογόνο'dan (idrogono) kelimesinden gelir.

Fosfor, simgesi P ve atom numarası 15 olan ve insan vücudunda kalsiyumdan sonra en fazla bulunan kimyasal elementtir.

Stearik asit, CH3(CH2)16COOH formülüyle gösterilen doymuş bir yağ asididir. Çoğu hayvan ve bitkiden elde edilen katı-sıvı yağlarda, ekseriya gliserid stearin şeklinde bulunur.

Naftalin veya naftalen, kapalı kimyasal formülü C10H8 olan, aromatik hidrokarbondur.

Gadolinyum, atom numarası 64, atom ağırlığı 156,9 olan, yüksek sıcaklıkta eriyen, birtakım tuzları bilinen, parlak gri renkte katı element. Manyetokalorik etkisi yüksektir. Manyetik soğutucu olarak kullanılır. En yüksek nötron yakalama tesir kesitine sahip kararlı elementtir. Bu yüzden nükleer reaktörlerde kontrol çubuklarında kullanılır.

Teknesyum, simgesi Tc ve atom numarası 43, atom ağırlığı yaklaşık 98 olan, sunî olarak elde edilen radyoaktif element. Nükleer tıpta kullanılır.

Asetilen (etin), bir tür hidrokarbondur. Üçlü bağ taşır ve formülü C2H2 şeklindedir. Alkin sınıfının ilk üyesidir.

Petrol rafinerisi (kısaca rafineri olarak da adlandırılır), petrol endüstrisi'nde ham petrolün arıtılarak ve çeşitli işlemlerden geçirilerek nafta, benzin, dizel yakıtı, sıvılaştırılmış petrol gazı, asfalt, kerosen, bitüm, gudron, mazut, petrol koku ve fuel oil gibi kullanışlı ürünlere dönüştürüldüğü bir endüstriyel işlem tesisidir.

Potasyum hidroksit ya da potasyum hidrat bir kimyasal bileşik. Akkor derecede uçucu olan, 360 °C'de eriyen, suda ısı açığa çıkararak çözünen, beyaz renkte katı bir maddedir. Alkalik bir baz olan potasyum hidroksidin geniş bir kullanım alanı vardır. Endüstride arap sabunu üretiminde, pillerde elektrolit olarak ve gübre yapımında kullanılır.

Bütirik asit , hayvansal ve bitkisel yağlarda bulunan bir doymuş yağ asididir. Bütirik asitin düşük molekül ağırlıklı esterlerinin hoş kokuları vardır, bu yüzden gıda ve parfüm katkısı olarak kullanılır.

Alkaloidler, yapılarında en az bir azot atomu içeren, doğal olarak meydana gelen ve bazik özellikteki bir organik kimyasal bileşikler sınıfıdır. Ancak bu sınıf içerisinde nötr ve hatta zayıf asidik özellikler gösteren bileşikler de yer almaktadır. Benzer yapıdaki bazı sentetik bileşikler de alkaloid olarak adlandırılabilir. Karbon, hidrojen ve azota ek olarak alkaloidler oksijen ve kükürt de ihtiva edebilirler. Daha nadir olmakla birlikte yapısında fosfor, klor ve brom taşıyanlarına da rastlanabilir.
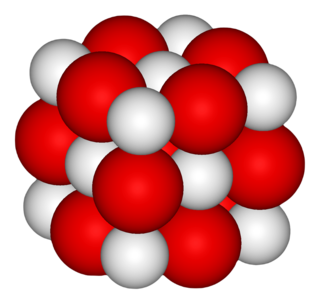
Kalsiyum oksit (CaO) ya da sönmemiş kireç geniş bir kullanım alanı bulunan bir çeşit kimyasal bileşiktir. Beyaz renkli, aşındırıcı ve alkalik bir katıdır. Sanayide kireç taşlarını yüksek sıcaklıklarda eriterek karbondioksidin uzaklaştırılmasıyla elde edilir. Suyla reaksiyona girerse oksitlenir ve kalsiyum hidroksidi oluşturur.
Etan, C2H6 formülüne sahip bir bileşiktir. Alkanların ikinci en küçük molekülü olan etan, normal sıcaklık ve basınçta kokusuz ve renksiz bir gazdır. Etan, doğalgazda metandan sonra en fazla bulunan ikinci gazdır.

Baryum perklorat formülü Ba(ClO4)2 olan bir kimyasal bileşiktir. Perklorik asitin baryum tuzu olan bu bileşik diğer perkloratlar gibi kuvvetli bir oksitleyicidir. Piroteknik endüstrisinde kullanılır.

Kalsiyum klorür (CaCl2), kalsiyum ve klorun tuz formudur. Bu bileşik tipik iyonik halojenür gibi hareket eder ve oda sıcaklığında katıdır. Yaygın uygulamaları tuzlu su olarak soğutma tesisleri, yollarda buz ve toz kontrolü ve kurutulması şeklindedir. Higroskopik doğası gereği susuz kalsiyum klorür hava-sızdırmaz kaplar içinde tutulmalıdır.

Silisyum dioksit veya silika, oksijen ve silisyum içeren kimyasal bileşik. Kimyasal formülü SiO2'dir. 16. yüzyıldan beri bilinmektedir. Cam, beton, fayans, porselen gibi birçok maddede kullanılmaktadır. SiO2, daha çok herhangi bir malzeme yerine, kristalin formları (polimorf) şeklinde bulunmaktadır. Kuvars, topaz ve ametist gibi 17 farklı kristal formu vardır.

1-Bütin ya da etilasetilen, büt-1-in, etiletin, UN 2452, C4H6 kimyasal formülüne sahip son derece yanıcı ve reaktif bir alkindir. Organik bileşiklerin sentezinde kullanılır. Renksiz bir gaz olarak oluşur.
Hidrojen tellür (tellan), H2Te formülüne sahip bir inorganik bileşiktir. Bir hidrojen kalkojenür ve tellürün en basit hidrürü, renksiz bir gazdır. Ortam havasında kararsız olmasına rağmen, gaz çürümüş sarımsak benzeri kokusu tarafından son derece düşük konsantrasyonlarda kolayca tespit edilebilecek kadar uzun konsantrasyonlarda bulunabilir; ya da çürümüş pırasa benzeri biraz daha yüksek konsantrasyonlarda kokusu ile. Te–H bağları (tellüroller) olan bileşiklerin çoğu, H2 kaybı açısından kararsızdır. H2Te kimyasal ve yapısal olarak hidrojen selenüre benzer, her ikisi de asidiktir. H–Te–H açısı yaklaşık 90° 'dir. Uçucu tellür bileşikleri genellikle çürümüş pırasa veya sarımsak anımsatan hoş olmayan kokulara sahiptir.

Potasyum sülfür K2S formülüne sahip inorganik bileşiktir. Potasyum sülfür suyla kolayca reaksiyona girip potasyum hidrosülfür (KHS) ve potasyum hidroksit (KOH) verdiğinden dolayı renksiz katı nadiren görülür. Yaygın olarak, potasyum sülfür ifadesi susuz katıyı değil de genel olarak bu karışımı ifade eder.
Doğal bolluk, bir element ya da izotopun, bir gezegende doğal olarak bulunduğu miktardır. Bir izotopun bolluğu gezegene göre ya da aynı gezegendeki farklı yerlere göre değişiklik gösterse de, kısa süreli ölçekte toplam bolluğu görece sabittir.



















