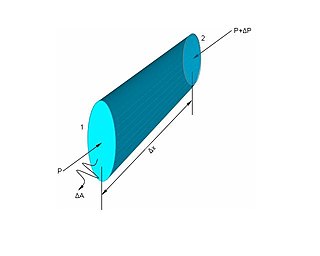
Basınç, bir yüzey üzerine etkide bulunan dik kuvvetin, birim alana düşen miktarı. Katı, sıvı ve gazlar ağırlıkları nedeniyle bulundukları yüzeye bir kuvvet uygularlar. Kuvvetin kaynağı ne olursa olsun birim yüzeye dik olarak etki eden kuvvete basınç (P), bütün yüzeye dik olarak etki eden kuvvete de basınç kuvveti (F) denir.

Bir fizik terimi olarak maddenin hâli, maddenin aldığı farklı fazlardır. Günlük hayatta maddenin dört farklı hâl aldığı görülür. Bunlar; katı, sıvı, gaz ve plazmadır. Maddenin başka hâlleri de bilinir. Örneğin; Bose-Einstein yoğunlaşması ve nötron-dejeneje maddesi. Fakat bu hâller olağanüstü durumlarda gerçekleşir, çok soğuk ya da çok yoğun maddelerde. Maddenin diğer hâllerininde, örneğin quark-gluon plazmalar, mümkün olduğuna inanılır fakat şu an sadece teorik olarak bilinir. Tarihsel olarak, maddenin özelliklerindeki niteleyici farklılıklara dayanarak ayrım yapılır. Katı hâldeki madde bileşen parçaları ile bir arada tutulur ve böylece sabit hacim ve şeklini korur. Sıvı hâldeki madde hacmini korur fakat bulunduğu kabın şeklini alır. Bu parçalar bir arada tutulur ama hareketleri serbesttir. Gaz hâlindeki madde ise hem hacim olarak hem de şekil olarak bulunduğu kaba ayak uydurur.Bu parçalar ne beraber ne de sabit bir yerde tutulur. Maddenin plazma hâli ise, nötr atomlarda dahil, hacim ve şekil olarak tutarsızdır. Serbestçe ilerleyen önemli sayıda iyon ve elektron içerirler. Plazma, evrende maddenin en yaygın şekilde görülen hâlidir.

Gaz, maddenin 4 temel hâlinden biridir. Bu haldeyken maddenin yoğunluğu çok az, akışkanlığı son derece fazladır. Gaz halindeki maddelerin belirli bir şekli ve hacmi yoktur. Katı bir madde ısıtıldığı zaman, katı halden sıvı, sıvı halden de gaz haline geçer. Bu duruma faz (safha) değişikliği denir. Sıvıyı meydana getiren tanecikler birbirlerini çeker. Sıvı ısıtıldığı zaman, tanecikler arasındaki çekim kuvveti yenilir ve tanecikler sıvı fazdan (ortamdan) ayrılarak gaz haline dönüşürler. Gazı meydana getiren tanecikler her yönde hareket edebilir ve bulundukları kabın hacmini alabilirler.

Erime noktası, kristal ve saf olan bir maddenin katı halden sıvı hale geçtiği belirli bir sıcaklıktır. Bu sıcaklığa o maddenin erime noktası denir. Bütün kristal yapıya sahip saf maddelerin erime noktasında, yani katı halden sıvı hale geçene kadar, sıcaklığı sabit kalır. Ancak tamamen sıvı hale geçtikten sonra sıcaklığı yükselir. Saf kristal cisimlerin erime noktası ile donma noktası arasında sıcaklık farkı yoktur. Mesela saf su, 0 °C de donar. Fakat saf olmayan maddelerin, yani karışımların donma ve erime noktaları farklıdır.

Entalpi, maddenin yapısında depoladığı her türden enerjilerin toplamıdır. H ile simgelenir. Bir mol maddede depolanmış enerjiye o maddenin molar entalpisi denir.

Katı, maddenin atomları arasındaki boşluğun en az olduğu halidir. "Katı" olarak adlandırılan bu haldeki maddelerin kütlesi, hacmi ve şekli belirlidir. Bir dış etkiye maruz kalmadıkça değişmez. Sıvıların aksine katılar akışkan değildir. Fiziksel yollarla, diğer üç hal olan sıvı, gaz ve plazmaya dönüştürülebilirler. Altın demir gibi madenler katı maddelere örnektir. Ayrıca katı maddeler atomlarının en yavaş hareket edebildiği haldir. Doğa'da amorf veya kristal yapıda bulunurlar. Amorf katılar maddenin taneciklerinin düzensiz olma durumudur. Kristal katılar ise de maddenin taneciklerinin düzenli olma durumudur. Kristal katılar da aralarında 4'e ayrılır.

Sıvı, maddenin ana hâllerinden biridir. Sıvılar, belli bir şekli olmayan maddelerdir; içine konuldukları kabın şeklini alır, akışkandırlar. Sıvı molekülleri, sıvı hacmi içinde serbest hareket ederler, fakat partiküllerin ortak çekim kabiliyeti, hacmin izin verdiği ölçüdedir. Sıvılar sıkıştırılamaz.

Çözelti ya da solüsyon, iki ya da daha fazla maddenin herhangi bir oranda bir araya gelerek oluşturdukları homojen karışımdır.

Çözünürlük, belli bir miktar çözünenin, belirli şartlar altında, spesifik bir çözücü içinde çözünmesidir. Çözücü akışkan solvent olarak adlandırılır ve birlikte çözeltiyi oluştururlar. Çözümlendirme işlemi solvasyon olarak adlandırılır.

Damıtma ya da destilasyon, iki veya daha fazla bileşen içeren bir karışımın ısıtılıp, buhar ve sıvı faz oluşturmak suretiyle daha uçucu bileşence zengin karışımların elde edilmesini sağlayan ayırma işlemidir. Ayırma işlemi sırasında, buhar faz daha uçucu olan A bileşeni tarafından zenginleşirken, sıvı faz ise kaynama sıcaklığı daha yüksek olan B bileşenince zenginleşir. Fakat yüzde 100 A içeren bir buhar faz elde edilemez.
Süblimleşme, katı maddelerin ısıtılınca, ara bir hâl olan sıvı hâle geçmeden doğrudan gaz hâle geçmesi. Süblimleşme endotermik faz değişimidir. Faz diyagramındaki üçlü noktanın altında gerçekleşir. Süblimleşme'nin tersine ise kırağılaşma denir.

Lars Onsager, Norveçli kimyacı. Daha sonra ABD vatandaşı olmuştur.
Doymuşluk bir çözeltideki çözünen madde oranıdır.

Kimyasal madde, kimyevî madde veya kısaca kimyasal, sabit bir kimyasal bileşimi ve karakteristik özelliklere sahip bir madde türüdür. Bu kimyasal bağlar bozulmadan, fiziksel ayırma yöntemleri ile bileşenlerine ayrılmaz. Bu kimyasallar katı, sıvı veya gaz hâlinde olurlar.
Sıcaklık ve basınç için standart koşullar ya da normal şartlar farklı veri setleri arasında karşılaştırma oluşturmaya izin vermek için kurulmuş olan deneysel olçümler için standart koşullardır. En çok kullanılan International Union of Pure and Applied Chemistry (IUPAC) ve National Institute of Standards and Technology (NIST) standartlarıdır. Bunlar tüm dünya tarafında kabul edilmese de en çok kullanılar standart setlerdir. Diğer organizasyonlar kendi standartları için çeşitli alternatifler bulmuşlardır.

Fiziksel bilimlerde faz; bir malzemenin fiziksel özelliklerinin her noktasında aynı olduğu bölgedir/alandır. Fiziksel özelliklerinin örneklerinden üç tanesi, yoğunluk içermesi, mıknatıslanma ve kimyasal bileşimi indeksi. Basit bir açıklama ile bir faz fiziksel olarak ayrı, kimyasal olarak yeknesak ve (genellikle) mekanik ayrılabilir malzemeli bir bölge olmasıdır. Bir cam kavanoz buz ve sudan oluşan bir sistemde, buz küpleri birinci faz, su ikinci faz ve suyun üstünde bulunan nem ise üçüncü fazdır. Cam kavanoz ise başka bir ayrı aşamasıdır. Faz terimi bazen maddenin hali olarak eş anlamlı bir şekilde kullanılabilir. Ancak bir maddenin aynı halde çok sayıda karışmayan fazı olabilir. Ayrıca, faz terimi bazen bir faz diyagramı için üzerinde sınır ile basınç ve sıcaklık gibi durum değişkenler açısından sınırı çizilmiş denge durumunda bir dizi oluşturmak için kullanılır. Faz sınırları gibi katı veya başka bir kristal yapısından daha ince değişikliğine sıvıdan bir değişiklik olarak maddenin organizasyon değişiklikleriyle ilgili olduğundan bu son kullanım durumuna eş anlamlısı olarak "faz" kullanımına benzer. Ancak, madde ve faz diyagramı kullanımların hali yukarıda verilen ve amaçlanan anlam terim kullanıldığı bağlamdan kısmen tespit edilmelidir resmi tanımı ile orantılı değildir. Fazın çeşitleri Farklı fazlar, gaz, sıvı, katı, plazma veya Bose-Einstein yoğuşma ürünü olarak maddenin farklı durumlar olarak tarif edilebilir. Maddenin katı ve sıvı formda diğer haller arasındaki faydalı mezofazlar.

Termodinamikte, çift taraflı Onsager bağıntıları, termodinamik sistemlerde termodinamik denge kavramının var olduğu yerlerde denge dışındaki akışlar ve kuvvetler arasındaki belirli oranların eşitliğini ifade eder.

Buhar basıncı ya da buhar denge basıncı; kapalı bir sistemdeki katı ya da sıvı fazdaki maddelerin termodinamik denge durumundaki buharının, belirli bir sıcaklıkta uyguladığı basınçtır. Bu değer, buharlaşma hızıyla doğru orantılıdır. Normal sıcaklıklarda görece yüksek buhar basıncına sahip maddeler, uçucu olarak tanımlanır.
Buhar, bir maddenin, kritik noktasından düşük bir sıcaklıktaki gaz fazıdır. Buhar fazındaki madde, sabit sıcaklıkta basıncın artmasıyla yoğunlaşarak sıvı faza dönüşebilir.














