Faz (madde)
| Termodinamik |
|---|
 |
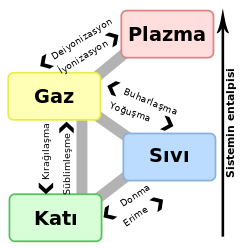
Fiziksel bilimlerde faz; bir malzemenin fiziksel özelliklerinin her noktasında aynı olduğu bölgedir/alandır (termodinamik bir sistemdir - İng: Thermodynamic system)[1][2]:86[3]:3. Fiziksel özelliklerinin örneklerinden üç tanesi, yoğunluk içermesi, mıknatıslanma ve kimyasal bileşimi indeksi. Basit bir açıklama ile bir faz fiziksel olarak ayrı, kimyasal olarak yeknesak ve (genellikle) mekanik ayrılabilir malzemeli bir bölge olmasıdır. Bir cam kavanoz buz ve sudan oluşan bir sistemde, buz küpleri birinci faz, su ikinci faz ve suyun üstünde bulunan nem ise üçüncü fazdır. Cam kavanoz ise başka bir ayrı aşamasıdır. Faz terimi bazen maddenin hali olarak eş anlamlı bir şekilde kullanılabilir. Ancak bir maddenin aynı halde çok sayıda karışmayan fazı olabilir. Ayrıca, faz terimi bazen bir faz diyagramı için üzerinde sınır ile basınç ve sıcaklık gibi durum değişkenler açısından sınırı çizilmiş denge durumunda bir dizi oluşturmak için kullanılır. Faz sınırları gibi katı veya başka bir kristal yapısından daha ince değişikliğine sıvıdan bir değişiklik olarak maddenin organizasyon değişiklikleriyle ilgili olduğundan bu son kullanım durumuna eş anlamlısı olarak "faz" kullanımına benzer. Ancak, madde ve faz diyagramı kullanımların hali yukarıda verilen ve amaçlanan anlam terim kullanıldığı bağlamdan kısmen tespit edilmelidir resmi tanımı ile orantılı değildir. Fazın çeşitleri Farklı fazlar, gaz, sıvı, katı, plazma veya Bose-Einstein yoğuşma ürünü olarak maddenin farklı durumlar olarak tarif edilebilir. Maddenin katı ve sıvı formda diğer haller arasındaki faydalı mezofazlar.

Fazın çeşitleri

Farklı fazlar, gaz, sıvı, katı, plazma veya Bose-Einstein yoğuşma ürünü olarak maddenin farklı durumlar olarak tarif edilebilir. Maddenin katı ve sıvı formda diğer haller arasındaki faydalı mezofazlar.
Farklı fazlar da maddenin belirli bir hal içinde var olabilir. Demir alaşımları için şemada gösterildiği gibi, çeşitli evreleri hem katı hem de sıvı haller için vardır. Fazlar ayrıca çözünürlüğe dayalı bir şekilde ayrılabilirler örneğin polar (hidrofil) ya da (hidrofobik) polar olmayan gibi. Su karışımı (bir polar sıvı) ve bir yağ (polar olmayan bir sıvı) kendiliğinden iki ayrı fazı olacaktır. Su, sıvı yağ içinde çok düşük çözünürlüğe sahiptir ve (çözünmeyen) yağda, su içinde düşük bir çözünürlüğe sahiptir. Çözünürlük maksimum miktardaki çözünenin çözücü içinde erimesi ile ortaya çıkar. Bir karışım iki sıvı fazından fazla olacak şekilde ayrılabilir ve fazların ayrılma kavramları katılara uzanabilir. Katılar katı çözeltileri ya da farklı kristal fazları oluşturabilirler. Metal çiftleri karşılıklı olarak alaşımlardan çözünebilirler. Karşılıklı çözünemeyen metal çiftleri ise çözünemezler.
Birçokları olduğu gibi sekiz karışmaz sıvı gözlenmiştir. Karşılıklı karışmaz sıvı fazlar sudan oluşturulmuştur, erimiş fosfor da su (sulu faz), hidrofobik organik çözücüler, perflorokarbonlar (florlu fazı), silikonlar, çeşitli metallerden oluşturulmuştur ve edilmektedir. Tüm organik çözücüler tamamen karışabilir. Örneğin Etilen glikol ve tolüen karışımı, iki farklı organik fazlar halinde ayrılabilir.
Fazlar makroskobik bir şekilde kendiliğinden ayrılması gerekmez. Emülsiyon ve kolloidler fiziksel ayrılmayan eriyebilen fazın karıştırılması çifti kombinasyonları örnekleridir.
Faz dengesi
Soldan dengeleme birçok homojen bileşimler ile bir tek faz oluşturmaktır ama sıcaklık ve basınca bağlı olduğundan tek bir maddenin iki veya daha fazla ayrı faza ayrılabilmektedir. Her faz içinde, özellikleri aynı ama iki farklı faz arasında özellikleri farklı bulunmaktadır.
Üzerinde hava boşluğu bulunan kapalı bir kavanozdaki su, iki fazlı bir sistem oluşturur. Suyun çoğu, su moleküllerinin karşılıklı çekimi ile tutulduğu sıvı fazdadır. Dengede bile moleküller sürekli hareket halindedir ve arada bir, sıvı fazdaki bir molekül, sıvı fazdan kopup gaz fazına girmek için yeterli kinetik enerji kazanır. Aynı şekilde, arada bir buhar molekülü sıvı yüzeyiyle çarpışır ve sıvıya yoğunlaşır. Dengede, buharlaşma ve yoğuşma süreçleri tam olarak dengelenir ve her iki fazın hacminde net bir değişiklik olmaz.
Su üzerindeki hava yaklaşık % 3 bir nem olduğunda, oda sıcaklığında ve basıncında su kabı dengeye ulaşır. Bu oran sıcaklık arttığı müddetçe artar. 100 °C'de ve atmosferik basınçta Hava % 100 su kadar dengeye ulaşmamıştır. Sıvı 100 °C'nin üzerinde biraz ısıtılır ise(su kaynar ise ) sıvıdan gaza geçişler sadece yüzeyde olmaz sıvının hacminde gerçekleşir.
Fazların numaraları
(İng:Multiphasic liquid)

Belirli bir bileşim için, sadece belirli fazlar, belirli bir sıcaklık ve basınçta mümkündür. Oluşturacak fazların sayısı ve türü, tahmin etmek zordur ve genellikle deney ile belirlenir. Bu tür deneylerin sonuçları faz diyagramlarında çizilebilir.
Burada gösterilen faz diyagramı tek bileşenli sistemi içindir. Mümkün fazlar sadece basınç ve sıcaklığa bağlıdır bu basit sistemde,. İşaretlemeler iki veya daha fazla fazın denge halinde bulundukları noktaları gösterir. Sıcaklıklar ve uzak işaretleme basınçlarda, dengede sadece bir faz olacaktır.
Şemada, sıvı ve gaz arasındaki sınırı işaretleme mavi çizgi süresiz devam etmez, ama kritik nokta denilen bir noktada sona erer. Sıcaklık ve basınç kritik noktaya yaklaştıkça, sıvı madde ve gazın özellikleri giderek daha fazla benzer hale gelir. Sıvı ve gazın ayırt edilmediği hale kritik nokta denir.. Kritik noktasının üstünde, artık ayrı bir sıvı ve gaz fazları vardır: süper kritik akışkan olarak adlandırılır, sadece genel bir sıvı fazı vardır. Suda, kritik nokta yaklaşık 647 K (374 °C veya 705 °F) 22,064 MPa gerçekleşir.
Su faz diyagramının bir sıra dışı özellik (noktalı yeşil çizgiyle gösterilen) katı-sıvı faz hattı negatif eğime sahip olmasıdır. Koyu yeşil hat örneklediği gibi çoğu maddeler için, eğim olumlu. Bu su olağandışı bir özelliği, sıvı sudan daha düşük bir yoğunluğa sahip olan buz ile ilgilidir. Basıncı artırarak erime neden olur yüksek yoğunluklu fazına, içine su sürücüler.
Faz diyagramının sıra dışı değil özelliği olsa bir başka ilginç katı-sıvı faz hattı sıvı-gaz fazı hattını karşılayan noktasıdır. Kesişme üçlü nokta olarak anılır. Üçlü noktada, tüm üç faz bir arada bulunabilir.
Deneysel, faz hatları nedeniyle birden çok fazlar formlarını geliştiren sıcaklık ve basınç bağımlılık eşleştirmek için nispeten kolaydır. Gibbs'in faz kuralı bakın. Bir piston ile donatılmış bir kapalı ve iyi yalıtılmış silindirin oluşan bir test aygıtı düşünün. Doğru miktarda su şarj ve ısı uygulama, sistem faz diyagramı gaz bölgesinde istenen herhangi bir noktaya getirilebilir. Piston yavaş düşer, sistem faz diyagramı gaz bölgede sıcaklık ve basınç artan bir eğri izler. Gaz sıvı yoğunlaşmaya başlar noktada, sıcaklık ve basınç eğrisinin yönü aniden suyun tüm yoğunlaşmış kadar faz hattı boyunca iz değişecektir.
Arayüzey olayları
(İng Surface science)
Dengedeki iki faz arasında dar bir bölge mevcuttur. Bu bölgede özellikler fazın özellikleri değildir. Bu yüzey çok ince olmasına rağmen, bu tür yüzey gerilimi gösteren bir sıvı neden olarak önemli ve kolaylıkla gözlemlenebilir etkilere sahip olabilir. Bunların karışımları, bazı bileşenler tercihli olarak arayüz doğru hareket edebilir. Modelleme, tanımlama veya belirli bir sistemin davranışını anlamak açısından, ayrı bir faz olarak ara yüz bölgesini tedavi etmek için etkili olabilir.
Kristal fazları
Tek bir malzemenin ayrı fazlar oluşturabilen çeşitli farklı katı halde olabilir. Su, bir malzemenin bilinen bir örnektir. Örneğin, meyveli dondurma normal altıgen bir şekilde buz Ih bulunan, ancak, aynı zamanda kübik buz içinde, rombohedral buz II ve birçok diğer formları halinde mevcut olabilir. Polimorfizm birden fazla kristal şeklinde mevcut olduğu, bir katı yeteneğidir. Saf kimyasal elementler için, polimorfizm allotropi olarak bilinir. Örneğin, elmas, grafit ve fulleren karbon farklı allotroplarıdır.
Faz değişimleri
Bir madde faz değişimine uğradığında (maddenin bir halinden diğerine geçiş yaparken), genellikle enerji alır ya da verir. Örneğin, su buharlaştığında, buharlaşan moleküller sıvının çekici kuvvetlerinden kaçarken kinetik enerjide oluşan artış, sıvının sıcaklığındaki düşüş olarak yansır. Faz değişimini başlatmak için gerekli olan enerji suyun iç termal enerjisinden alınmaktadır, bu da sıvının daha düşük bir sıcaklığa doğru soğumasına sebep olur; Bu yüzden buharlaşma soğutma işlemleri açısından kullanışlı bir yöntemdir. Bakınız: Buharlaşma ısısı. Bunun tam tersi olan süreç olan yoğuşma ısı veren bir süreçtir. Bir katının sıvıya doğru faz geçişiyle ilgili olan ısı enerjisi ya da entalpi, ergime ısısı (İng: enthalpy of fusion) olarak ve bir katının gaza doğru faz geçişiyle ilgili olan ısı enerjisi ise süblimleşme ısısı (İng: enthalpy of sublimation) olarak adlandırılır.
Ayrıca bakınız
- Arayüz (madde) (İng:Interface (matter))
- Faz sınırı (İng: Phase boundary)
Kaynakça
- ^ Modell, Michael; Robert C. Reid (1974). Thermodynamics and Its Applications. Englewood Cliffs, NJ: Prentice-Hall. ISBN 0-13-914861-2.
- ^ Enrico Fermi (25 Nisan 2012). Thermodynamics. Courier Corporation. ISBN 978-0-486-13485-7.
- ^ Clement John Adkins (14 Temmuz 1983). Equilibrium Thermodynamics. Cambridge University Press. ISBN 978-0-521-27456-2.
Dış bağlantılar
- Fransız fizikçiler, sıcaklık artışı ile birlikte katılaşan bir solüsyon/karışım buldular 4 Temmuz 2007 tarihinde Wayback Machine sitesinde arşivlendi. – α-Siklodekstrin(İng:cyclodextrin), su ve 4-metilpiridin (İng:methylpyridine)