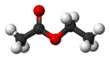
Etil asetat
| |||
 | |||
| Adlandırmalar | |||
|---|---|---|---|
Etil asetat | |||
Sistematik IUPAC adı Etil etanoat | |||
Diğer adlar Asetik ester Asetik asit etil esteri Asetik eter | |||
| Tanımlayıcılar | |||
CAS numarası | |||
3D model (JSmol) | |||
| ECHA InfoCard | 100.005.001 | ||
| E numaraları | E1504 (ilave kimyasallar) | ||
| RTECS numarası |
| ||
CompTox Bilgi Panosu (EPA) | |||
| |||
| Özellikler | |||
| Molekül formülü | C4H8O2 | ||
| Molekül kütlesi | 88,105 g/mol | ||
| Görünüm | renksiz sıvı | ||
| Yoğunluk | 0,897 g/cm³, sıvı | ||
| Erime noktası | −83,6 °C 190 K, -118 °F | ||
| Kaynama noktası | 77,1 °C, 350 K, 171 °F | ||
| Çözünürlük (su içinde) | 8,3 g/100 mL (20 °C) | ||
| Akmazlık | 0,426 cP – 25 ° | ||
| Tehlikeler | |||
| GHS etiketleme sistemi: | |||
| R-ibareleri | R11, R36, R66, R67 | ||
| G-ibareleri | S16, S26, S33 | ||
| NFPA 704 (yangın karosu) | |||
| Parlama noktası | −4 °C | ||
| Öldürücü doz veya konsantrasyon (LD, LC): | |||
LD50 (medyan doz) | 11,3 g/kg | ||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |||
Etil asetat (sistematik adıyla etil etanoat, kısa yazımla EtOAc veya EA), CH3COOCH2CH3 formüllü bir organik bileşiktir. Bu renksiz sıvı bileşiğin bazı yapıştırıcılar ve oje gibi tatlı bir kokusu vardır. Zehirli değildir. Etil asetat, etanol ve asetik asitin esteri olup, sanayide güçlü bir çözücü olması nedeniyle sık üretilen bir maddedir. Yapıştırıcılar, ojeler, oje çıkarıcılar ve kahveden kafeinin çıkarılmasında sıklıkla kullanılmaktadır.
Etil asetat 1985 yılında, Japonya, Kuzey Amerika ve Avrupa'da toplam yaklaşık 400,000 ton üretildi.[1] 2004'te ise bu miktar dünya çapında yaklaşık 1.3 milyon tonu buldu.[2]
Üretim
Etil asetat, sanayide genellikle klasik Fischer esterleşmesi yoluyla, etanol ve asetik asit tepkimeye sokularak üretilir. Bu karışım oda sıcaklığında %65 oranında esterleşir:
- CH3CH2OH + CH3COOH ⇌ CH3COOCH2CH3 + H2O
Tepkime asit katalizlemesi yoluyla hızlandırılabilir ve denge suyun ortadan alınmasıyla sağa doğru kaydırılabilir. Etil asetatın bir diğer üretim yolu Tishchenko tepkimesi olup, asetaldehit türevlerinin alkoksit ile karıştırılması esasına dayanır:
- 2 CH3CHO → CH3COOCH2CH3
Etanolün dehidrojenasyonu yolu
Özelleştirilmiş bir sanayide üretim yolu, etanolün katalitik dehidrojenasyonunu zorunlu kılmaktadır. Bu yöntem her ne kadar esterleştirme yönteminden ucuz olsa da, gereğinden fazla etanole gereksinim duymaktadır. Tipik olarak dehidrojenasyon, 250 °C'ye kadar ısıtılmış bakır aracılığıyla yönetilir. Bakırın yüzey alanı, çinkoya yatırıldığında yükselme gösterebilir ve parçalanmış görünümlü dendritlerin oluşumuna yol açabilir. Yüzey alanı daha sonra bir zeolit türü olan ZSM-5'e yatırılarak tekrar arttırılır. Eser miktarda nadir elementler ve alkali metaller bu işlemde katkı sağlar. Dehidrojenasyondaki yan ürünler arasında dietil eter de yer alır. Bu yan ürünlerin ayrışması oldukça karmaşıktır.
Kullanımı
Etil asetat genel olarak çözücü ve seyreltici olarak kullanılır. Ucuz oluşu, düşük toksisitesi ve hoş kokusu nedeniyle de tercih edilir. Örneğin reklam afişlerini temizlemek ve oje çıkarmak üzere kullanılır. Bu çözücü, kahvedeki ve çaydaki kafeini uzaklaştırır.[3] Boyalarda aktivatör ve sertleştirici olarak da kullanılan etil asetat, şekerlemelerde, parfümlerde ve bazı meyvelerde vardır. Parfümlerde kullanımı sırasında çabucak buharlaştığından dolayı, parfüm kokusunu deride bırakarak yüzeyden ayrılır. Ojelerde, izopropil alkol ve bütil asetat ile birlikte çözücü olarak kullanılır.
Laboratuvar kullanımı
Laboratuvarlarda etil asetat içeren karışımlar kolon kromatografisinde ve ayrıştırmalarda kullanılır. Etil asetat nadiren tepkime çözücüsü olarak kullanılır,çünkü hidroliz ve bir organik asit esterini başka bir estere dönüştürme işlemi sırasında bu madde dayanıksızdır. Etil asetat, organik kimyada ve özellikle deneylerde uçucu ve düşük kaynama noktasına sahip oluşu nedeniyle sıcak su banyosunda basınçlı hava püskürtülerek ayrılabilmektedir.
Şaraptaki durumu
Etil asetat, şaraptaki en bilinen ester, gıdalarda kullanılan en bilinen uçucu organik bileşiktir. Etil asetat fermantasyon aşamasında üretilir.
Bileşiğin aroması taze şarapta daha keskindir. Ancak aşırı etil asetat, şarabın kalitesini düşürür. Bu durumda, havadaki oksijenle temasıyla etanol asetaldehite dönüşür ve şarabın tadı sirke gibi olur.[4]
Diğer kullanımlar
Böcekbilim alanında etil asetat böceklerin toplanıp incelenmesi için etkili boğuculuğundan dolayı tercih edilir. İçine etil asetat konulmuş öldürme kavanozuna konulan böcek, hızla buharlaşan bu bileşiği soluyarak, vücut yapısı zarar görmeden boğularak ölür. Higroskopik olmadığından dolayı etil asetat böceği yumuşak bırakarak böcek koleksiyonu için uygun ortam hazırlar.
Tepkimeler
Etil asetat sadece zayıf bir Lewis bazıdır. I2, fenol ve bis(hekzafloroasetilasetonato)bakır (II) ile 1:1 eklentiler oluşturur.
Etil asetat, asidik veya bazik koşullarda hidroliz edilerek asetik asit ve etanolün eldesinde kullanılır. Bir asit katalizörün kullanılması bu tepkimeyi hızlandırır. Bazlar, yukarıda bahsedilen Fischer dengesine tabi olan hidrolizi hızlandırır.
Laboratuvar ortamında etil esterler genelde sodyum hidroksit gibi güçlü bir bazın stokiyometrik miktarıyla başlayan iki aşamalı bir işlemde hidrolize edilir. İlk aşamada stokiyometrik oranda sodyum hidroksit gibi güçlü bir baz bulunur ve sonuç olarak Etanol ve etanole karşı tepkime göstermeyen sodyum asetat oluşumu gözlenir:
- CH3CO2C2H5 + NaOH → C2H5OH + CH3CO2Na
Susuz koşullar altında, güçlü bazlar Claisen yoğunlaşmasını etil asetoasetat verecek şekilde indükler:[5]

Etil asetoasetatın hazırlanması.
Güvenlik
Sıçanlar için LD50'si, 5620 mg/kg'dır,[6] bu da düşük akut toksisitesidir olduğunu gösterir. Kimyasalın birçok organizmada doğal olarak bulunduğu göz önüne alındığında, çok düşük bir toksisite riski vardır.
Kaynakça
- ^ Wilhelm Riemenschneider, Hermann M. Bolt "Esters, Organic" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. DOI: 10.1002/14356007.a09_565.pub2. Article Online Posting Date: April 30, 2005
- ^ Dutia, Pankaj (10 Ağustos 2004). "Ethyl Acetate: A Techno-Commercial Profile" (PDF). Chemical Weekly. s. 184. 21 Ağustos 2018 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 21 Mart 2009.
- ^ "Folgers.com". 29 Temmuz 2009 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Mart 2010.
- ^ J. Robinson (ed) "The Oxford Companion to Wine" Third Edition pg 259 Oxford University Press 2006 ISBN 0-19-860990-6
- ^ Inglis, J. K. H.; Roberts, K. C. (1926). "Ethyl Acetoacetate". Org. Synth. 6: 36. doi:10.15227/orgsyn.006.0036.
- ^ Hazard Ethyl Acetate MSDS "Ethyl Acetate MSDS Number: E2850". 19 Haziran 2003 tarihinde kaynağından arşivlendi.
Dış bağlantılar
- NIOSH Cep Rehberi, Kimyasal tehlikeler 27 Ağustos 2016 tarihinde Wayback Machine sitesinde arşivlendi. (İngilizce)
- Uluslararası Kimyasal Güvenlik Kartları Chemical Safety Cards (İngilizce)
- MSDS – etil asetat (İngilizce)
- Ulusal Kirletici Çizelgesi - Etil asetat çizelgesi (İngilizce)
- Etil Asetat: Ayın Molekülü (İngilizce)
- Esterleştirme yapmak için derişik sülfürik asit kullanımı (İngilizce)
- SEKAB Tarifnamesi (İngilizce)
- Etil asetatın buhar basıncı 18 Temmuz 2011 tarihinde Wayback Machine sitesinde arşivlendi., sıvı yoğunluğu 18 Temmuz 2011 tarihinde Wayback Machine sitesinde arşivlendi., dinamik sıvı akmazlığı 18 Temmuz 2011 tarihinde Wayback Machine sitesinde arşivlendi., yüzey gerilimi 18 Temmuz 2011 tarihinde Wayback Machine sitesinde arşivlendi. değerleri (İngilizce)