Kimya, maddenin yapısını, özelliklerini, birleşimlerini, etkileşimlerini, tepkimelerini araştıran ve uygulayan bilim dalıdır. Kimya bilmi daha kapsamlı bir ifadeyle maddelerin özellikleriyle, sınıflandırılmasıyla, atomlarla, atom teorisiyle, kimyasal bileşiklerle, kimyasal tepkimelerle, maddenin hâlleriyle, moleküller arası ve moleküler kuvvetlerle, kimyasal bağlarla, tepkime kinetiğiyle, kimyasal dengenin prensipleriyle vb konularla ilgilenir. Kimyanın en önemli dalları arasında analitik kimya, anorganik kimya, organik kimya, fizikokimya ve biyokimya sayılır.

Elektron dizilimi, atom fiziği ve kuantum kimyasında, bir atom ya da molekülün elektronlarının atomik ya da moleküler orbitallerdeki dağılımıdır. Örneğin Neon atomunun elektron dizilimi 1s2 2s2 2p6 olarak gösterilir.

Alkenler yapılarında en az bir tane karbon-karbon (C=C) çift bağı içeren organik bileşiklerdir. Alkenlerin yapısında karbon-karbon çift bağı bulunduğundan ve bu karbonların yapabileceği en fazla hidrojenle bağ yapmamış olduğundan alkenler doymamış bileşikler kategorisine girerler. Alkenlerin yapısında sadece bir karbon-karbon çift bağının bulunması durumunda homolog seriler oluşturur. Bu homolog serilerin genel formülü CnH2n şeklindedir. Burada n-in en az 2 olma şartı vardır. Aşağıda en basit alken olan eten, yaygın ismiyle etilenin, çeşitli modellemelerle çizilmiş şekillerinin yanı sıra alkenlerin çeşitli şekillerdeki yazılış şekilleri de bulunmaktadır.

Organik kimya, organik bileşiklerin ve organik maddelerin yani karbon atomlarını içeren çeşitli formlardaki maddelerin yapısını, özelliklerini ve reaksiyonların bilimsel çalışmasını içeren, kimyanın bir alt dalıdır. Yapının incelenmesi yapısal formüllerini belirler. Özelliklerin incelenmesi, fiziksel ve kimyasal özellikleri ve davranışlarını anlamak için kimyasal reaktivitenin değerlendirilmesidir. Organik reaksiyonların incelenmesi doğal ürünlerin, ilaçların ve polimerlerin kimyasal sentezini ve bireysel organik moleküllerin laboratuvarda ve teorik çalışma yoluyla incelenmesidir.

Kovalent bağ, atomlar arasında elektron çiftleri oluşturmak için elektronların paylaşımını içeren kimyasal bağdır. Bu elektron çiftlerine paylaşılan çiftler veya bağ çiftleri denir. Atomlar arasında elektronları paylaştıklarında çekici ve itici kuvvetlerin kararlı dengesine kovalent bağ denir. Birçok molekül için elektronların paylaşılması her atomun kararlı elektronik gruplaşmasına denk gelen tam değerlik kabuğunun eşdeğerine ulaşmasına olanak tanır.

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.

Sör John Edward Lennard-Jones İngiliz bir matematikçi ve Bristol Üniversitesi'nde teorik fizik ve ardından Cambridge Üniversitesi'nde teorik bilim profesörü idi. Modern hesaplamalı kimyanın, günümüz sayısal kimya alanının kurucusu olarak kabul edilebilir.

Enerji seviyesi, atom çekirdeğinin etrafında katman katman biçiminde bulunan kısımların her biridir. Bu yörüngelerde elektronlar bulunur. Yörüngenin numarası; 1, 2, 3, 4, ... gibi sayı değerlerini alabilir. Yörünge numarasına baş kuantum sayısı da denir ve "n" ile gösterilir. Yörünge numarası ile yörüngenin çekirdeğe uzaklığı doğru orantılıdır.
Kinetik teori veya gazların kinetik teorisi, gazların basınç, sıcaklık, hacim gibi makroskobik özelliklerini moleküler bileşim ve hareketlerine bağlı olarak açıklayan teoridir. Esas olarak, teori Isaac Newton'un kanısının tersine basıncın moleküller arası statik itmeden kaynaklanmadığını, bunun yerine belli hızlarda hareket eden moleküller arası çarpışmalardan kaynaklandığını söyler. Kinetik teori aynı zamanda kinetik-moleküler teori veya çarpışma teorisi olarak da bilinir.

Kimyada istiflenme, genelde aromatik olan moleküllerin atomlar arası etkileşerek deste şeklinde üst üst üste gelmesidir. İstiflenmiş bir sistemin en yaygın bilinen örneği DNA molekülünde birbirini takibeden bazlarda görülür. İstiflenme proteinlerde, non-polar iki halkanın örtüşmesi halinde de meydana gelir. Hangi moleküllerarası kuvvetlerin istiflenmeye neden olduğu hâlen tartışma konusudur.

Organik kimyada bazı atom halkalarının yapısı beklenenin üstünde kararlıdır. Doymamış bağlar, yalın elektron çiftleri veya boş orbitallerden oluşan konjüge bir halkanın konjüge olmasından beklenecek kararlılıktan daha yüksek bir kararlılık gösterme özelliğine aromatiklik denir. Aromatiklik, halkasal delokalizasyon ve rezonansın bir belirtisi olarak da düşünülebilir.
Değerlik kabuğu elektron çifti itmesi kuralları moleküllerin şekillerini tahmin etmede kullanılır ve değerlik elektron çiftlerinin birbirlerini elektrostatik kuvvetle itmesi temeline dayanır. Teorinin yaratıcısı olan bilim adamlarına atfen Gillespie–Nyholm teorisi olarak da adlandırılır. "VSEPR" kısaltması kimi zaman "vespır" olarak da telaffuz edilebilir.
Teoriye göre atomları çevreleyen değerlik elektron çiftleri birbirlerini iterek aralarındaki itme kuvvetini en aza indirirler ve böylece moleküle şeklini verirler. Merkez atoma bağlı atomların sayısı ile bağ yapmamış elektron çiftlerinin sayısının toplamı sterik numarayı verir.
Moleküller arası kuvvet, komşu parçacıklar arasında etkili çekim veya itme kuvvetidir. Molekülleri bir arada tutan iç kuvvetlere kıyasla daha zayıftır. Örneğin HCI moleküllerinin içinde bulunan kovalent bağ, birbirine yeterince yakın komşu moleküller arasında mevcut olan kuvvetlerden daha güçlüdür.

Azulen organik bir bileşiktir ve Naftalinin bir izomeridir. Naftalinin renksiz olmasına karşın, azulen koyu mavi bir renge sahiptir. İki terpenoid, vetivazulen (4,6-dimetil-2-izopropilazulen) ve guaiazulen (1,4-dimetil-7-izopropilazulen), bu özelliklere sahip azulen iskeletli maddeler, doğal olarak mantar pigmentlerinde, Peygamber ağacı yağında ve bazı deniz omugasızlarında bulunabilir.

Yöresizleşmiş elektronlar veya delokalize elektronlar bir katı metal, iyon veya molekülde bulunan elektronların tek bir atom veya kovalent bağ ile ilişkili olmamasını tanımlar.
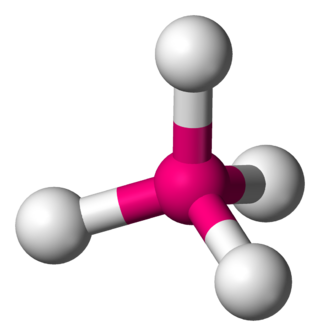
Dörtyüzlü veya tetrahedral molekül geometrisi, merkezi atomun, dört yüzlünün ortasında, dört köşede ise sübstitüentlerin yer aldığı molekül geometrisidir. Bağ açıları, dört sübstitüent aynı olduğunda (örn. metan CH4 ya da daha ağır analogları) cos−1 (-⅓) = 109,4712206 ...° ≈ 109.5° olur. Metan veya diğer simetrik yüzlü moleküller Td nokta grubuna aittir, ama dörtyüzlü moleküller genellikle düşük simetriye sahiptir. Tetrahedral moleküller kiral olabilir.

Albert Eschenmoser (5 Ağustos 1925, Erstfeld - 14 Temmuz 2023), karmaşık heterosikilik doğal bileşiklerin, en önemlisi B12 vitamininin, sentezi üstüne çalışmaları ile tanınan İsviçreli organik kimyager. Organik sentez alanına yaptığı önemli katkıların yanı sıra, Eschenmoser'in yapay nükleik asitlerin sentetik yolları üstüne çalışmalarıyla Hayatın Kaynağı üstüne öncü çalışmaları vardır. 2009'da emekli olmadan önce ETH Zürih ve La Jolla, Kaliforniya'daki Scripps Araştırma Enstitüsü'ne bağlı Skaggs Kimyasal Biyoloji Enstitüsü'nde profesörlükleri vardı. Ayrıca Chicago Üniversitesi, Cambridge Üniversitesi ve Harvard Üniversitesi'nde misafir profesör olarak çalıştı.

Kimyasal yapının belirlemesi, bir kimyagerin hedef molekülün moleküler geometrisini ve -uygun ve gerekli olduğunda- elektronik yapısını belirlemesini içerir. Moleküler geometri, bir moleküldeki atomların uzamsal düzenini ve atomları bir arada tutan kimyasal bağları ifade eder ve yapısal formüller ile moleküler modeller kullanılarak temsil edilebilir; eksiksiz elektronik yapı açıklamaları, bir molekülün moleküler orbitallerinin konumunun belirlenmesini içerir. Yapı belirleme, çok basit moleküllerden çok karmaşık olanlara kadar bir dizi hedefe uygulanabilir.
Polimer kimyası, polimerlerin ve makromoleküllerin kimyasal sentezine, yapısına ve kimyasal ve fiziksel özelliklerine odaklanan bir kimya alt disiplinidir. Polimer kimyasında kullanılan ilkeler ve yöntemler, organik kimya, analitik kimya ve fiziksel kimya gibi çok çeşitli diğer kimya alt disiplinleri aracılığıyla da uygulanabilir. Pek çok malzeme tamamen inorganik metaller ve seramiklerden DNA ve diğer biyolojik moleküllere kadar polimerik yapılara sahiptir, ancak polimer kimyası tipik olarak sentetik, organik bileşimler bağlamında anılır. Sentetik polimerler, genellikle plastik ve kauçuk olarak adlandırılan, günlük kullanımdaki ticari malzemeler ve ürünlerde her yerde bulunur ve kompozit malzemelerin ana bileşenleridir. Polimer kimyası, her ikisi de polimer fiziği ve polimer mühendisliğini kapsayacak şekilde tanımlanabilen daha geniş polimer bilimi veya hatta nanoteknoloji alanlarına da dahil edilebilir.
Karbon-karbon bağı, iki karbon atomu arasındaki kovalent bir bağdır. En yaygın şekli tekli bağdır: iki atomun her birinden birer tane olmak üzere iki elektrondan oluşan bir bağ. Karbon-karbon tekli bağı bir sigma bağıdır ve karbon atomlarının her birinden bir hibridize orbital arasında oluşur. Etanda orbitaller sp3-hibridize orbitallerdir, ancak diğer hibridizasyonlara sahip karbon atomları arasında oluşan tek bağlar meydana gelir. Aslında, tekli bağdaki karbon atomlarının aynı hibridizasyona sahip olması gerekmez. Karbon atomları ayrıca alken adı verilen bileşiklerde çift bağ veya alkin adı verilen bileşiklerde üçlü bağ oluşturabilir. Bir çift bağ, sp2-hibritleşmiş bir orbital ve hibritleşmeye dahil olmayan bir p-orbitali ile oluşturulur. Üçlü bağ, sp-hibritleşmiş bir orbital ve her atomdan iki p-orbitali ile oluşturulur. P-orbitallerinin kullanımı bir pi bağı oluşturur.















