Emilim (kimya)
Kimyada absorpsiyon veya emilim, fiziksel veya kimyasal fenomen veya atomların, moleküllerin veya iyonların bir yığın fazına (sıvı veya katı malzemeye) giriş sürecidir. Bu adsorpsiyondan farklı bir işlemdir, çünkü adsorpsiyonda moleküller yüzey tarafından alınmasına rağmen absorpsiyona (emilim) uğrayan moleküller hacim tarafından alınır.
Daha yaygın bir tanım, "Emilim, emilen maddenin moleküllerinin, atomlarının ve iyonlarının malzemenin yığın fazına (gaz, sıvı veya katı) alındığı/girdiği kimyasal veya fiziksel bir fenomendir."
Daha genel bir terim ise, adsorpsiyon ve iyon değişimini kapsayan Soğurmadır (Sorption) . Absorpsiyon, bir şeyin başka bir maddeyi alması durumudur.[1]
Teknolojide önemli olan birçok proseste, fiziksel prosesin yerine kimyasal absorpsiyon kullanılır, örneğin karbon dioksitin sodyum hidroksit tarafından absorpsiyonu (bu tür asit-baz prosesleri Nernst bölme yasasına uymaz) (bkz: çözünürlük ).
Bu etkinin bazı örnekleri için sıvı-sıvı ekstraksiyonuna bakınız. Kimyasal reaksiyon olmadan bir sıvı fazdan diğerine bir çözünen sağlamak mümkündür. Bu tür çözünenlere örnek olarak soy gazlar ve osmiyum tetroksit verilebilir.[1]
Absorpsiyon süreci, bir maddenin enerjiyi yakaladığı ve dönüştürdüğü anlamına gelir. Emici, yakaladığı malzemeyi bütüne dağıtırken adsorban sadece yüzey boyunca dağıtır.
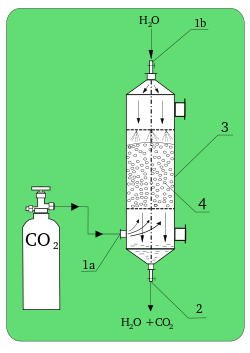
Adsorbanın gövdesine nüfuz eden gaz veya sıvı süreci genel olarak absorpsiyon olarak bilinir.

Denklem
Absorpsiyon, başka herhangi bir fiziksel veya kimyasal işlemin eşlik etmediği fiziksel bir işlemse, genellikle Nernst dağıtım yasasına uyar :
- "Bazı çözünen türlerinin konsantrasyonlarının, belirli bir çözünen ve kütle fazları için dengede ve temas halindeyken iki yığın fazdaki konsantrasyonlarının oranı":
K N sabitinin değeri sıcaklığa bağlıdır ve bölme katsayısı olarak adlandırılır. Bu denklem, eğer konsantrasyonlar çok büyük değilse ve "x" türü, "1" veya "2" fazlarından herhangi birinde formunu değiştirmiyorsa geçerlidir. Eğer böyle bir molekül birleşmeye veya ayrışmaya maruz kalırsa, bu denklem yine de her iki fazda da "x" arasındaki dengeyi tanımlar, ancak sadece aynı form için - kalan tüm formların konsantrasyonları, diğer tüm dengeler dikkate alınarak hesaplanmalıdır.[1]
Absorpsiyon türleri
Absorpsiyon, kimyasal (reaktif) veya fiziksel (reaktif olmayan) olabilen bir süreçtir.
Kimyasal absorpsiyon
Kimyasal absorpsiyon veya reaktif absorpsiyon, absorbe edilen ve absorbe edilen maddeler arasındaki kimyasal reaksiyondur. Bazen fiziksel emilim ile birleşir. Bu tip absorpsiyon, reaksiyonun stokiyometrisine ve reaktanlarının konsantrasyonuna bağlıdır. Geniş bir faz akış tipi ve etkileşim yelpazesi ile farklı birimlerde gerçekleştirilebilirler. Çoğu durumda RA, plaka veya dolgulu kolonlarda gerçekleştirilir.[2]
Fiziksel emilim
Katı halde su
Biyolojik kökenli birçok katı içeren hidrofilik katılar, suyu kolayca emebilir. Su ile katının molekülleri arasındaki polar etkileşimler, suyun katıda dağılmasını kolaylaştırır, bu da nispeten düşük nemde bile su buharının önemli ölçüde emilmesine izin verebilir.
Nem geri kazanımı
Atmosfere maruz kalmış bir lif (veya başka bir hidrofilik malzeme), kurumuş hissi verse bile genellikle bir miktar su içerecektir. Su, bir fırında ısıtılarak uzaklaştırılabilir, bu da ağırlıkta ölçülebilir bir azalmaya yol açar, Bahse konu lif 'normal' atmosfere tekrar döndürülürse kademeli olarak nemini geri kazanacaktır. Bu etki, bir malzemenin ağırlığının sudan oluşan oranına nem geri kazanımı adı verilen tekstil endüstrisinde çok önemlidir.[3]
Ayrıca bakınız
- Lamm-Hönigmann süreci
Kaynakça
- ^ a b c Fundamentals of Organic Chemistry. Fifth. Agnus McDonald. 2003. ss. 409. ISBN 0-534-39573-2. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Gehör, Seppo; Eijärvi, Erkki (10 Nisan 2012). "Characteristics and potential applications of coarse clay fractions from Puolanka, Finland". Central European Journal of Engineering. 2 (2): 239-247. doi:10.2478/s13531-011-0067-9. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım) - ^ "Moisture regain - CAMEO". cameo.mfa.org (İngilizce). 25 Eylül 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Eylül 2018.
![{\displaystyle {\frac {[x]_{1}}{[x]_{2}}}={\text{constant}}=K_{N(x,12)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e0ec1ce71d0ce27734b33e4d1dfae04be91ecf13)

















