
Fizikte enerji, bir cisime veya fiziksel bir sisteme aktarılan, işin performansında ve ısı ve ışık biçiminde tanınabilen niceliksel özelliktir. Enerji korunan bir miktardır; Enerjinin korunumu yasası, enerjinin istenen biçime dönüştürülebileceğini ancak yaratılamayacağını veya yok edilemeyeceğini belirtir. Uluslararası Birimler Sisteminde (SI) enerjinin ölçü birimi joule'dür (J).
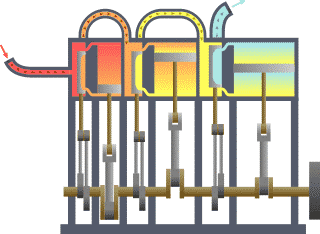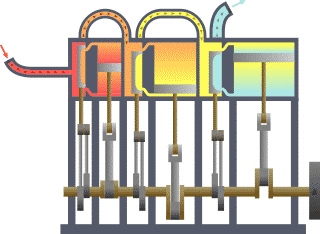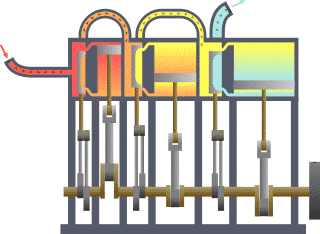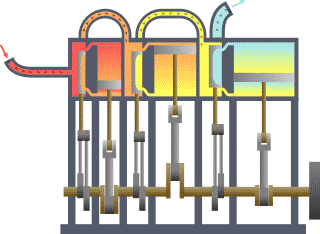
Termodinamik; ısı, iş, sıcaklık ve enerji arasındaki ilişki ile ilgilenen bilim dalıdır. Basit bir ifadeyle termodinamik, enerjinin bir yerden başka bir yere ve bir biçimden başka bir biçime transferi ile ilgilenir. Bu süreçteki anahtar kavram, ısının, belirli bir mekanik işe denk gelen bir enerji biçimi olmasıdır.

Fotosentez, bitkiler ve diğer canlılar tarafından, ışık enerjisini organizmaların yaşamsal eylemlerine enerji sağlamak için daha sonra serbest bırakılabilecek kimyasal enerjiye dönüştürmek için kullanılan bir işlemdir. Bu kimyasal enerji, karbondioksit ve sudan sentezlenen şekerler gibi karbonhidrat moleküllerinde depolanır.

Kimyasal tepkime ya da kimyasal reaksiyon, iki veya daha fazla maddenin birbiri ile etkileşmesi sonucu kendi özelliklerini kaybederek yeni özellikte maddeler oluşturmasıdır. Kimyasal olay ve kimyasal değişme kavramlarıyla eşanlamlıdır. Kimyasal reaksiyonların test edilmesi için Periyodik tablo metalleri ile aside koyarak yapılabilir.
Hidroliz işlemi suyu oluşturan hidrojen ve oksijen elementlerinin birbirinden ayrılması ile sonuçlanan bir işlemdir. Bazı kaynaklarda hidroliz, moleküllerin su ilavesiyle daha fazla sayıda parçacık oluşturması olarak da geçer. Hidroliz, su ile bir kimyasal bağın parçalanmasıdır yani bir kimyasal reaksiyondur. Hidroliz genel olarak suyun nükleofil olduğu ikame(yer değiştirme reaksiyonu), eliminasyon(organik reaksiyon türü) ve solvasyon (çözme) reaksiyonları için kullanılır.

Entalpi, maddenin yapısında depoladığı her türden enerjilerin toplamıdır. H ile simgelenir. Bir mol maddede depolanmış enerjiye o maddenin molar entalpisi denir.

'Adenozin trifosfat, hücre içinde bulunan çok işlevli bir nükleotittir. İngilizce Adenosine Triphosphateden ATP olarak kısaltılır. En önemli işlevi hücre içi biyokimyasal reaksiyonlar için gereken kimyasal enerjiyi taşımaktır. Fotosentez ve hücre solunumu sırasında oluşur. ATP bunun yanı sıra RNA sentezinde gereken dört monomerden biridir. Ayrıca ATP, hücre içi sinyal iletiminde protein kinaz reaksiyonu için gereken fosfatın kaynağıdır. 3 tane fosfattan oluşur.
Termodinamikte, ısıalan (endotermik) kelimesi, ısı formunda enerji yutan reaksiyon veya işlem olarak tanımlanır. Endotermik kelimesinin köküne baktığımızda ‘’endo-‘’ “içine” anlamında önek, ‘’-termik’’ ise “ısıtmak” anlamına gelmektedir. Isıalan bir olayın zıddı, ısıveren yani ısı formunda enerji veren bir işlemdir. ”Endotermik” terimi ilk kez Marcellin Berthelot tarafından ortaya atılmıştır.

Nükleer reaksiyon veya çekirdek tepkimesi, iki atom çekirdeğinin veya bir atom çekirdeğiyle atom dışından bir atomaltı parçacığın çarpışarak bir veya daha fazla yeni nüklide dönüşmeleri. Bu gibi reaksiyonlarda yer alan atomaltı parçacıklar proton, nötron veya yüksek enerjili elektron olabilir. Kimyasal reaksiyondan farkı, kimyasal reaksiyonların atomların elektronları arasında gerçekleşmesidir. Çekirdek tepkimesi sonucunda eğer proton sayısı değişiyor ise farklı bir elemente ait bir tanecik oluşmuş olur. Bir reaksiyonun nükleer reaksiyon sayılabilmesi için en az bir nüklidin başka bir nüklide dönüşmesi gerekir; böyle bir dönüşüm gerçekleşmezse yaşanan çarpışma sürecine saçılma adı verilir. Spontane olarak gerçekleşen radyoaktif bozunma, nüklit değişimine yol açsa da nükleer reaksiyon olarak kabul edilmez.
Elektrokimya, kimya biliminin bir alt dalı olup elektronik bir iletken ile iyonik bir iletken (elektrolit) arayüzeyinde gerçekleşen reaksiyonları inceler. Elektrokimyada amaç kimyasal enerji ve elektrik enerjisi arasındaki değişimi incelemektir.

Redoks atomların oksidasyon durumlarının değiştiği bir tür kimyasal reaksiyondur. Redoks reaksiyonları, kimyasal türler arasında elektronların fiili veya biçimsel aktarımı ile karakterize edilir, çoğunlukla bir tür oksidasyona, diğer türler indirgemeye uğrar. Elektronun çıkarıldığı kimyasal türlerin indirgenmiş olduğu söyleniyor. Başka bir deyişle:
- Oksidasyon, elektronların bir atom ya da molekülden ayrılmasını sağlayan kimyasal tepkimedir.
- Redüksiyon, bir atomun elektron almasını sağlayan kimyasal tepkimedir.
Kimyasal reaktiflik, bir reaksiyonun meydana gelme eğilimiyle ilişkilidir. Kimyasal tepkimelerin gerçekleşmesini belirleyen faktörler termodinamik düzeyinde incelenir. Termodinamik olarak bir reaksiyon eğer tepkimenin ürünleri reaktanlara kıyasla daha düşük serbest enerji düzeyinde ise gerçekleşir. Diğer taraftan Reaktiflik ise genel olarak bir maddenin kimyasal değişikliklere ya da kimyasal tepkimelere girme eğilimine denir. Elementlerin atomik yapısı ve elektronlarının dizilişi elementlerin ve oluşturdukları moleküllerin reaktifliğinde önemli rol oynar. Soygazların örneğin kimyasal olarak çok az reaktiflik gösterdiği belirtilir. Dolayısıyla kimyasal bileşik oluşturmaları zordur. Bu durum soygazların tam dolu olan en dış elektron kabuğundan dolayıdır.
Kimyasal denge, asit ve baz kimyası, elektron aktarımı tepkimesi ve entropi gibi konular kimyasal reaktifliğin temel kavramlarıdır.

Enerji dönüşümü enerjinin bir biçimden diğerine dönüşümüdür. Fizikte enerji terimi bir sistemdeki belirli değişiklikleri oluşturma kapasitesini açıklar. Dönüşümde entropinin sınırlamaları göz ardı edilir. Sistemlerin toplam enerji dönüşümü, yalnızca enerjinin eklenmesi veya çıkarılması ile sağlanabilir. Termodinamiğin birinci kanununa göre enerji, dönüştürülebilen bir büyüklüktür. Bir sistemin toplam kütle miktarı, enerjisinin bir ölçüsüdür. Bir sistemdeki enerji dönüştürülebildiğinden dolayı, farklı bir hale veya başka bir biçime dönüşebilir. Çoğu haldeki enerji, birçok fiziksel iş yapmak için kullanılabilir. Enerji doğal süreçler veya makinelerde kullanılabilir. Ayrıca ısı, ışık veya harekete dönüşebilir. Örneğin bir güneş pili, güneş ışınımını elektrik enerjisine dönüştürür ve böylece ampul yanar veya bilgisayara güç sağlanır.
Biyolojik Termodinamik, hücrelerin, yapıların, organizmaların arasında veya içinde gerçekleşen enerji dönüşümlerini ve bu dönüşümlerin temelini oluşturan kimyasal süreçlerin işleyişini inceleyen kantitatif (sayısal) bir daldır. Biyolojik Termodinamik herhangi belirli bir fenotipik nitelikle özdeşleşen kazancın gerekli olan enerjiyle değişimine değip değmeyeceği sorusunu sorabilir.

Termodinamikte, sistemin termodinamik durumu, durum fonksiyonları olarak bilinen uygun değişken değerleriyle tam olarak tanımlanabilir. Termodinamik değişkenlerinin değerleri bir sistem için bir kere belirlendiğinde, termodinamiğin bütün özelliklerinin değerleri eşsiz bir şekilde belirlenmiş olur. Genellikle, termodinamik durum termodinamik dengenin biri olarak varsayılır. Yani, bu durum bir sistemin sadece belli bir süredeki durumu değil, durum süresiz uzunlukta aynı ve değişmezdir.
Reaksiyon kinetiği olarak da bilinen kimyasal kinetik, kimyasal reaksiyonların hızlarını ve mekanizmalarını araştırmakla ilgilenen bir fiziksel kimya dalıdır. Bir sürecin gerçekleştiği yön ile ilgilenen ancak gerçekleşme hızları hakkında bir bilgi vermeyen termodinamik ile karıştırılmamalıdır. Kimyasal kinetik, deneysel koşulların kimyasal reaksiyonların hızı üzerine etkilerini, reaksiyon mekanizmaları ile geçiş hâllerinin verim bilgilerini ve kimyasal reaksiyonların karakteristiklerini tanımlayan matematiksel modellerin çıkarılmasını kapsayan bir bilim alanıdır.

Kimyasal reaktörler bir kimyasal reaksiyonun gerçekleştirildiği proses ekipmanlarıdır. Kimya mühendisliğinde proses tasarımı ve analizinde sık kullanılan klasik bir ünite prosesidir. Bir kimyasal reaktörün tasarımı, kimya mühendisliğinin birden fazla unsurunun kullanılmasını gerektirir. Reaktörler proseste ham maddelerin ürünlere dönüştüğü oldukça temel bir ekipman olduğundan proses tasarımı açısından büyük önem arz eder. Kimya mühendisleri bir reaksiyonun net bugünkü değerini en üst düzeye çıkarmak için reaktörler tasarlar. Tasarımcılar satın alma ve işletme maliyetini en düşük seviyelerde tutarken bir yandan da üretilen ürün miktarını en yüksek seviyede tutmak için reaksiyonun ürünler yönünde mümkün olan en yüksek verimle devamlılığını sağlarlar. Enerji girişi, enerji çıkışı, ham madde maliyetleri, işçilik vb. işletme giderlerine örnek olarak verilebilir. Isıtma, soğutma, basıncı artırmak için pompalama, sürtünmeden kaynaklı basınç düşüşü ve çöktürme gibi durumlar da enerji değişimlerine birer örnektir.
Çözülme, çözücünün moleküller ile etkileşimini tanımlar. Hem iyonize hem de yüksüz moleküller, çözücü ile güçlü bir şekilde etkileşir ve bu etkileşimin gücü ve doğası, çözücünün viskozite ve yoğunluk gibi özelliklerini etkilemenin yanı sıra çözünürlük, reaktivite ve renk dahil olmak üzere çözülen maddenin birçok özelliğini etkiler. Çözülme sürecinde iyonlar eş merkezli bir çözücü kabuğu ile çevrelenir. Çözülme, çözücü ve çözünen moleküllerin çözünme kompleksleri halinde yeniden düzenlenmesi sürecidir.
Biyolojik süreçler, bir organizmanın yaşaması için hayati önem taşıyan ve çevresiyle etkileşime girme kapasitesini şekillendiren süreçlerdir. Biyolojik süreçler, yaşam formlarının devamlılığı ve dönüşümünde rol oynayan birçok kimyasal reaksiyon veya diğer olaylardan oluşur. Metabolizma ve homeostaz örnek olarak verilebilir.
Isıl bozunma, bir malzemenin yüksek sıcaklıklara maruz kaldığında kimyasal ve fiziksel değişikliklere uğramasıdır. Bu, malzemenin yapısının, özellikle moleküler seviyede, sıcaklığın etkisiyle bozulduğu bir süreçtir. Isıl bozunma, farklı malzemeler ve uygulamalar için farklı sonuçlara yol açabilir. Isıl bozunmanın temel özellikleri ve önemli noktaları:
- Sıcaklık: Isıl bozunma, malzemenin belirli bir sıcaklık eşiğine ulaştığında gerçekleşir. Bu sıcaklık malzemenin türüne ve özelliklerine bağlı olarak değişebilir. Örneğin, bazı organik bileşenler düşük sıcaklıklarda bozunabilirken, metaller daha yüksek sıcaklıklarda bozunma eğilimindedir.
- Kimyasal Değişimler: Isıl bozunma sırasında malzeme kimyasal olarak değişebilir. Moleküler bağlar kırılabilir veya yeniden düzenlenebilir. Bu nedenle, yeni bileşikler oluşabilir veya mevcut bileşenler ayrışabilir.
- Fiziksel Değişiklikler: Isıl bozunma, malzemenin fiziksel özelliklerini de etkileyebilir. Örneğin, malzeme eriyebilir, buharlaşabilir veya hacmi değişebilir.
- Endotermik ve Egzotermik Reaksiyonlar: Isıl bozunma reaksiyonları endotermik veya eksotermik olabilir. Endotermik reaksiyonlar, ısı emer ve çevre sıcaklığını düşürürken, eksotermik reaksiyonlar ısı yayar ve çevre sıcaklığını artırır.
- Uygulamalar: Isıl bozunma, birçok endüstriyel ve bilimsel uygulamada önemlidir. Örneğin, enerji üretimi, metalurji, kimya, gıda işleme, malzeme bilimi ve ilaç üretimi gibi alanlarda ısıl bozunma reaksiyonları kullanılır.
- Kontrol Edilmesi: Isıl bozunma reaksiyonları sıklıkla belirli sıcaklık aralıklarında ve belirli atmosfer koşullarında gerçekleştirilir. Bu, istenen sonuçların elde edilmesini sağlar.
- Karakterizasyon: Isıl bozunma reaksiyonları, malzemenin bileşimi ve özellikleri üzerinde etkiler yarattığı için bu reaksiyonların karakterizasyonu önemlidir. Analitik teknikler, bu reaksiyonların izlenmesi ve anlaşılmasında kullanılır.









