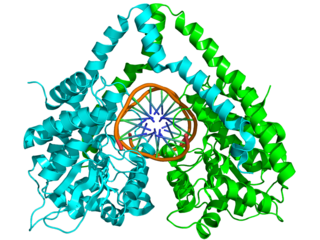
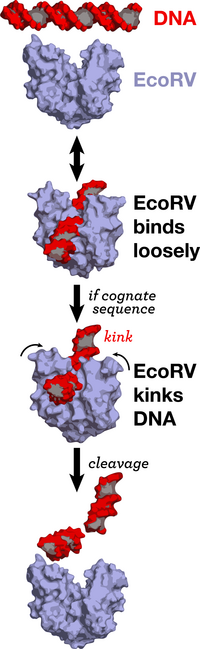
EcoRV



Escherichia coli' den elde edilen bir kısıtlama enzimi olan EcoRV ("eco R beş" olarak telaffuz edilir), en iyi karakterize edilen endonükleazlardan biri olup palindromik (simetrik) dna dizilerini tanıyan ve genellikle homodimerler veya homotetramerler gibi davranan Tip IIP alt sınıfındadır.[1][2][3]
EcoRV enzimi, GATATC hedef bölgesini TA adımında merkezden ve kör uçlu bir şekilde bölen, Mg2 + ' ya bağımlı bir reaksiyonda 5′-fosfat grupları oluşturan dimerik bir tip II kısıtlama endonükleazdır.[4]
EcoRV, DNA boyunca gerçekleşen translokasyonda ATP'ye ihtiyaç duymayan tip II ailesinin en iyi çalışılmış restriksiyon enzimlerden biridir.[5] Kataliz ve özgüllük bakımından bu enzim, DNA bükülmesi öneminin keşfedilmesinde model olarak kullanılmıştır.[6]
EcoRV' nin izoşizomerleri, BstRI, CeqI, Eco32I, Ecol78I, HjaI, NanI, NflAI, NsiCI şeklindedir.[7]
Yapı
EcoRV endonükleaz, 244 amino asit içerir ve “dimerizasyon alt alan” adı verilen küçük alt alan ile “DNA bağlanma alt alanı” adı verilen alanın da bulunduğu daha büyük bir alt alandan oluşan bir dimerdir.[8] EcoRV, normalde kestiği diziyi içeren bir DNA molekülü ile beraber kristalleştirilmiştir. Bu kristal kullanılarak bu protein-DNA kompleksinin yapısı çözülmüştür.[8][9] Enzimin çekirdek kısmı beş tane beta yaprak, bunların iki yanında da alfa sarmallar bulunmaktadır. Bu çekirdek bölge diğer tip II restriksiyon endonükleazlarına benzer. N-ucunda bir ikilenme (dimerizasyon) bölgesi vardır, bu bölge kısa bir α-sarmal, iki antiparalel β yaprak ve bir uzun α-sarmaldan oluşur. Bu bölge sadece EcoRV ve PvuII'de görülür.[10]
EcoRV, serbest enzim, bir spesifik olmayan ve iki spesifik kompleksle birlikte bir enzim-ürün kompleksinin yapı analizlerinin bulunduğu tek kısıtlama enzimidir.[11]
Etki mekanizması
EcoRI gibi EcoRV de bir homodimer (ikili) oluşturduktan sonra DNA'ya bağlanır ve tanıma dizisini keser. Enzim önce DNA'da herhangi bir yere zayıf şekilde bağlanır, sonra DNA üzerinde rastgele yürür, spesifik tanıma dizisini bulana kadar.[10] Proteindeki rastgele bağlanma yeri ile kesme yeri farklıdır.[12] EcoRV kendi tanıma dizisi için yüksek bir spesifiteye sahiptir. Enzim DNA üzerinde kayarken önce tanıma dizisinin dıştaki iki bazını (GAxxTC) tanır ve DNA'ya daha sıkı bağlanır, sonra eğer dizinin ortasındaki bazlar da doğruysa DNA eğrilir, proteinin bağlanması daha da sıkılaşır ve kesme meydana gelir.[13]
Enzimin dizisine bağlanması DNA'da şekilsel bir değişime yol açar, DNA 50° bükülür. Proteinin C -ucundaki pozitif yükler bu bükülmeyi sağlamaktadır.[14] DNA bölgesinde meydana gelen keskin bir bükülme ile fosfat, katalitik yan zincir (Asp90, Asp74, Lys92) ve iki değerlikli metal iyonların uygun bir şekilde yan yana gelmesi kolaylaşır.[15] Aynı zamanda bükülmeyle DNA' nın TA aşamasındaki ana oluğun daralmasına sebep olarak enzimin fonksiyonel gruplarının bazlarla hidrojen bağları yapmasını engeller.[15] DNA'nın bükülmesi bazların istiflenmesini bozar, küçük oluk açılır, büyük oluk sıkışır. Bu durum kesilecek fosfodiester bağını enzimin aktif bölgesine yaklaştırıp orada kesilmesini sağlar. Kesilme tanıma dizisi içinde gerçekleşir ve ATP gerektirmez.[10]
Enzimin aktif bölgesinde üç tane divalent metal iyonu bulunur. Bunlardan ikisi nükleofilik bir hidroksit iyonunu oluşturmaya yarar.[16][17]
EcoRV, protein etkisiyle DNA'da şekilsel bir değişiklik yapan tek tip II restriksiyon endonükleazdır.[10]
EcoRI ve EcoRV' nin spesifik komplekslerinin kristalografik analizi, bu iki enzimin katalitik bölgelerini tanımladı.[18] Analiz sonucunda katalitik bölgeleri karşılaştırıldığında, yapı ve davranış açısından iki enzimin benzer olduğu bulundu.[18]
Kullanım
EcoRV çoğunlukla gen klonlaması sırasında bir plazmid vektörü kesip içine araştırma konusu olan bir geni yerleştirmek için kullanılır.[3]
Moleküler klonlama, Restriksiyon bölgesi haritalama, Genotipleme, Southern lekeleme tekniği, Restriksiyon fragman uzunluğu polimorfizmi (RFLP), SNP (Tek nükleotid polimorfizm) analizi uygulamalarında kullanılır.[19]
EcoRV, DNA' nın GAT^ATC bölgelerini uygun bir tamponda 37 °C 'de keser.[19][20][21] Bu enzim, pek çok imalatçı tarafından temin edilir, gerektiği biçimde çalışması için, enzimin stabilitesini artıran ve DNA preparasyonlarında bulunabilecek kontaminantları bağlayan inek serum albümini (BSA) ile birlikte kullanılır.[3][19][21] BSA tampon yerine Rekombinant Albümin (rAlbumin) içeren tamponla birlikte de kullanılmaktadır.[22][23]
Bu enzim temin edildikten sonra saklama koşulları oldukça önemlidir. -20 °C sıcaklığında donmayan dondurucularda saklanması gerekir.[21][24]
Genetik
EcoRV endonükleazının geni ve EcoRV ile aynı DNA dizisini tanıyan EcoRV metilazın genleri kromozomda birbirine bitişiktir, transkripsiyonları aynı bölgeden zıt yönlere doğru yapılır.[25]
Ayrıca bakınız
- EcoRI, E. coli'ye ait bir diğer endonükleaz.
- EcoRII, E. coli'ye ait başka bir endonükleaz..
- FokI, Flavobacterium okeanokoites'e ait bir nükleaz.
- BamHI, Bacillus amyloliquefaciens' e ait bir endonükleaz.
- PvuII, Proteus vulgaris' e ait bir endonükleaz.
Kaynakça
- ^ Zahran, Mai; Daidone, Isabella; Smith, Jeremy C.; Imhof, Petra (2010). "Mechanism of DNA Recognition by the Restriction Enzyme EcoRV". Journal of Molecular Biology (İngilizce). 401 (3): 415-432. doi:10.1016/j.jmb.2010.06.026. 14 Haziran 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ocak 2023.
- ^ Pingoud, Alfred; Wilson, Geoffrey G.; Wende, Wolfgang (8 Temmuz 2014). "Type II restriction endonucleases—a historical perspective and more". Nucleic Acids Research (İngilizce). 42 (12): 7489-7527. doi:10.1093/nar/gku447. ISSN 0305-1048. PMC 4081073 $2. PMID 24878924. 14 Kasım 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Ocak 2023.
- ^ a b c "EcoRV". www.bionity.com (İngilizce). 24 Ocak 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Ocak 2023.
- ^ Horton, Nancy C; Perona, John J (1998). "Role of protein-induced bending in the specificity of DNA recognition: crystal structure of Eco RV endonuclease complexed with d(AAAGAT) + d(ATCTT) 1 1Edited by P. E. Wright". Journal of Molecular Biology (İngilizce). 277 (4): 779-787. doi:10.1006/jmbi.1998.1655. 4 Haziran 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ocak 2023.
- ^ Dikić, Jasmina; Menges, Carolin; Clarke, Samuel; Kokkinidis, Michael; Pingoud, Alfred; Wende, Wolfgang; Desbiolles, Pierre (2012). "The rotation-coupled sliding of EcoRV". Nucleic Acids Research (İngilizce). 40 (9): 4064-4070. doi:10.1093/nar/gkr1309. ISSN 1362-4962. PMC 3351190 $2. PMID 22241781. 14 Ağustos 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Ocak 2023.
- ^ David A. Hiller and John J. Perona. "The positively charged C-terminal subdomains of EcoRV endonuclease: contributions to DNA binding, bending and cleavage". doi:10.1021/bi0606400. 13 Ocak 2023 tarihinde kaynağından arşivlendi.
- ^ Roberts, R. J. (25 Nisan 1990). "Restriction enzymes and their isoschizomers". Nucleic Acids Research (İngilizce). 18 (suppl): 2331-2365. doi:10.1093/nar/18.suppl.2331. ISSN 0305-1048. PMC 331877 $2. PMID 2159140.
- ^ a b Winkler FK, Banner DW, Oefner C; ve diğerleri. (Mayıs 1993). "The crystal structure of EcoRV endonuclease and of its complexes with cognate and non-cognate DNA fragments". EMBO J. 12 (5). ss. 1781-95. PMC 413397 $2. PMID 8491171.
- ^ "EcoRV Endonuclease/DNA complex". Protein Data Bank. 5 Şubat 2012 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Ocak 2011.
- ^ a b c d Pingoud A, Jeltsch A (2001). "Structure and functions of type II restriction endonucleases". Nucleic Acids Research. 29 (18). ss. 3705-3727. doi:10.1093/nar/29.18.3705. PMC 55916 $2. PMID 11557805.
- ^ Pingoud, Alfred; Jeltsch, Albert (15 Mayıs 1997). "Recognition and Cleavage of DNA by Type-II Restriction Endonucleases". European Journal of Biochemistry (İngilizce). 246 (1): 1-22. doi:10.1111/j.1432-1033.1997.t01-6-00001.x. ISSN 0014-2956.
- ^ Schulze, C; Jeltsch, A; Franke, I; Urbanke, C; Pingoud, A (1998). "Crosslinking the EcoRV restriction endonuclease across the DNA-binding site reveals transient intermediates and conformational changes of the enzyme during DNA binding and catalytic turnover". EMBO J. Cilt 17. ss. 6757-66. doi:10.1093/emboj/17.22.6757. PMC 1171021 $2. PMID 9822618.
- ^ Zahran M, Daidone I, Smith JC, Imhof P (2010). "Mechanism of DNA recognition by the restriction enzyme EcoRV". J. Mol. Biol. Cilt 401. ss. 415-32. doi:10.1016/j.jmb.2010.06.026. PMID 20600128.
- ^ PMID 16981705
- ^ a b Hiller, David A.; Perona, John J. (1 Eylül 2006). "Positively Charged C-Terminal Subdomains of EcoRV Endonuclease: Contributions to DNA Binding, Bending, and Cleavage". Biochemistry (İngilizce). 45 (38): 11453-11463. doi:10.1021/bi0606400. ISSN 0006-2960. PMC 2515858 $2. PMID 16981705. 13 Ocak 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Ocak 2023.
- ^ Horton NC, Perona JJ (2004). "DNA cleavage by EcoRV endonuclease: two metal ions in three metal ion binding sites". Biochemistry. Cilt 43. ss. 6841-57. doi:10.1021/bi0499056. PMID 15170321.
- ^ Horton, Nancy C.; Newberry, Kate Juliet; Perona, John J. (10 Kasım 1998). "Metal ion-mediated substrate-assisted catalysis in type II restriction endonucleases". Proceedings of the National Academy of Sciences (İngilizce). 95 (23): 13489-13494. doi:10.1073/pnas.95.23.13489. ISSN 0027-8424. PMC 24846 $2. PMID 9811827. 25 Ocak 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Ocak 2023.
- ^ a b Pingoud, Alfred; Wilson, Geoffrey G.; Wende, Wolfgang (30 Mayıs 2014). "Type II restriction endonucleases—a historical perspective and more". Nucleic Acids Research. 42 (12): 7489-7527. doi:10.1093/nar/gku447. ISSN 0305-1048. PMC 4081073 $2. PMID 24878924.
- ^ a b c "Eco32I (EcoRV) (10 U/µL)". www.thermofisher.com (İngilizce). 10 Şubat 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Ocak 2023.
- ^ "EcoRV". 23 Ocak 2023 tarihinde kaynağından arşivlendi.
- ^ a b c "Addgene: Molecular Biology Protocol - Restriction Digest of Plasmid DNA". www.addgene.org. 30 Ekim 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Ocak 2023.
- ^ "EcoRV | NEB". www.neb.com. 30 Temmuz 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Ocak 2023.
- ^ "NEBuffer™ System: Same high performance, now with Recombinant Albumin (rAlbumin) | NEB". www.neb.com. 18 Nisan 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Ocak 2023.
- ^ "EcoRV protocol" (PDF). 24 Ocak 2023 tarihinde kaynağından (PDF) arşivlendi.
- ^ Bougueleret L, Schwarzstein M, Tsugita A, Zabeau M (1984). "Characterization of the genes coding for the Eco RV restriction and modification system of Escherichia coli". Nucleic Acids Res. Cilt 12. ss. 3659-76. PMC 318777 $2. PMID 6328432.