Dopamin
 | |
 | |
| Adlandırmalar | |
|---|---|
4-(2-aminoethyl)benzene-1,2-diol | |
Diğer adlar Oksitiramin, Prolaktin inhibe edici faktör, Prolaktin inhibe edici hormon | |
| Tanımlayıcılar | |
CAS numarası | |
3D model (JSmol) | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.000.101 |
| KEGG | |
PubChem CID | |
CompTox Bilgi Panosu (EPA) | |
| |
| Özellikler | |
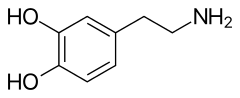
| Kimyasal formül | C8H11NO2 |
| Molekül kütlesi | 153,18 g mol−1 |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |
Dopamin (DA, 3,4-dihidroksifeniletilamin), hücrelerde ve canlılarda önemli rol oynayan nöromodülatör bir moleküldür. Çoğu hayvanda ve bazı bitkilerde sentezlenir. Katekolamin ve feniletilamin familyasından olan bir organik bileşiktir.[1] Beyin ve böbreklerde sentezlenen L-DOPA molekülünden bir adet karboksil grubunun çıkarılmasıyla sentezlenen bir amindir. Dopamin, merkezi sinir sisteminde nörotransmiter olarak görev yapar. Nörotransmitterler beynin belirli bölgelerinde sentezlenir, ancak sistemsel olarak birçok bölgeyi etkilerler. Beyin, biri ödül sisteminde önemli bir rol oynayan birkaç farklı dopamin yolağı içerir. Hafıza, hareket, motivasyon, ruh hali ve dikkat süresi dahil olmak üzere birçok vücut fonksiyonunda rol oynar.[2] Genellikle yapılması durumunda sonucunda ödül beklenen eylemler ve aktiviteler, beyindeki dopamin seviyesini artırır.[3] Birçok bağımlılık yapan ilaç dopamin seviyelerini arttırarak çalışır.[4]
Popüler kültürde ve medyada, dopamin genellikle "mutluluk hormonu" olarak tasvir edilir. Ancak farmakolojideki mevcut görüş, dopaminin sonucunda ödül beklenen aktiviteler için motivasyon hissiyatında (arzu etme) rol oynadığıdır. Eğer yapılması düşünülen eylem sonucunda ödül getirmiyor ise veya eylemin sonucu canlı için öneme sahip değilse dopamin salgısında azalma, eğer eylemin sonucunda beklenen bir ödül (örnek; yemek pişiren bir kişi, yemeği yeme ödülü ile motive olarak hareket eder) var ise dopamin salgısında artış görülür.[5][6][7][8]
Merkezi sinir sisteminin dışında, dopamin temel olarak hücrelerin iletişiminde rol oynar. Kan damarlarında norepinefrin salınımını inhibe eder ve vazodilatör görevi görür; böbreklerde sodyum atılımını ve idrar çıkışını artırır; pankreasta insülin üretimini azaltır; sindirim sisteminde gastrointestinal motiliteyi (içeriğin sindirim sistemi boyunca hareket etme hızı) azaltır ve bağırsak mukozasını korur; bağışıklık sisteminde lenfositlerin aktivitesini azaltır.
Sinir sisteminin bazı hastalıkları, dopamin sisteminin işlev bozuklukları ile ilişkilidir. Bu hastalıkları tedavi etmek için kullanılan bazı temel ilaçlar, dopaminin etkilerini değiştirerek çalışır. Parkinson hastalığı (PD), Huntington hastalığı, fibromiyalji, dikkat eksikliği ve hiperaktivite bozukluğu (DEHB), huzursuz bacak sendromu, madde kullanım bozuklukları, bipolar bozukluk, obsesif-kompulsif bozukluk (OKB), majör depresif bozukluk ve şizofreni dopamin sistemi bozuklukları ile ilişkilendirilmiştir.[9]
Görevleri
Hücresel etkileri
| Familya | Reseptör | Gen | Tip | Menakizma |
|---|---|---|---|---|
| D1-benzeri | D1 | DRD1 | Gs-bağlı | Hücre içi cAMP seviyelerini adenilat siklaz enzimini aktive ederek arttırır |
| D5 | DRD5 | |||
| D2-benzeri | D2 | DRD2 | Gi-bağlı | Hücre içi cAMP seviyelerini adenilat siklaz enzimini inhibe ederek azaltır |
| D3 | DRD3 | |||
| D4 | DRD4 | |||
| TAAR | TAAR1 | TAAR1 | Gs-bağlı Gq-bağlı | Hücre içi kalsiyum ve cAMP seviyelerini arttırır |
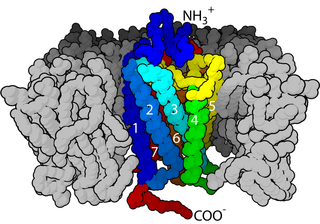
Dopamin, etkilerini hücre yüzeyi reseptörlerine bağlanarak ve aktive ederek gösterir.[12] Ayrıca insalarda dopamin, TAAR1 reseptörü için yüksek bir afiniyete sahiptir.[10][11] Memelilerde, D1'den D5'e kadar beş alt tip dopamin reseptörü tanımlanmıştır.[12] Dopaminin kendisini stimülan veya inhibitör olarak tanımlamak yanlıştır. Dopaminin bir hedef nöron üzerindeki etkisi, o nöronun zarında hangi tip reseptörlerin bulunduğuna ve o nöronun ikinci haberci cAMP'ye verdiği iç tepkilere bağlıdır.[12]
Depolanması, serbest bırakılması ve geri alınımı
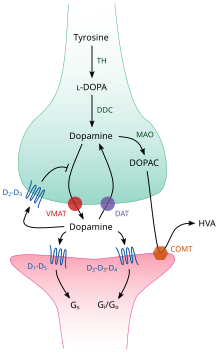
Beynin içinde, dopamin bir nörotransmitter ve nöromodülatör olarak işlev görür ve tüm monoamin nörotransmiterlerinde ortak olan bir dizi mekanizmalar tarafından kontrol edilir.[12] Sentezlendikten sonra dopamin, hücre içi sıvıdan (sitozol) sinaptik veziküle bir tür veziküler monoamin taşıyıcı olan VMAT2 tarafından taşınır.[13] Dopamin, sinaptik boşluğa atılana kadar bu veziküllerde depolanır. Genellikle, dopamin salınımı, aksiyon potansiyelinin neden olduğu ekzositoz adı verilen bir süreç yoluyla gerçekleşir, ancak hücre içi TAAR1 aktivitesi de dopamin salınımını tetikleyebilir.[11]
Sinapsa girdikten sonra dopamin, dopamin reseptörlerine bağlanır ve onları aktive eder.[14] Bu aktive edilen reseptörler, dendritlerde (postsinaptik nöron) bulunan postsinaptik dopamin reseptörleri veya bir akson terminalinin (presinaptik nöron) zarında bulunan presinaptik otoreseptörler'den (örneğin, D2sh ve presinaptik D3 reseptörleri) biri olabilir.[12][14] Postsinaptik nöron bir aksiyon potansiyeli ortaya çıkardıktan sonra, dopamin molekülleri hızla reseptörlerinden bağımsız hale gelir. Daha sonra ya dopamin taşıyıcısı ya da plazma membranı monoamin taşıyıcısı tarafından aracılık edilen geri alım yoluyla presinaptik hücreye geri emilirler.[15] Sitozole geri döndüğünde dopamin, monoamin oksidaz tarafından katalize edilebilir veya VMAT2 tarafından veziküllere geri taşınarak tekrar kullanılabilir.[13]
Merkezi sinir sistemi

Merkezi sinir sisteminde (MSS) dopamin; hareket, bilişsellik, duygulanım ve nöroendokrin salgılanımının kontrolünde rol oynar.[16] "Dopaminerjik" hücre grupları ve yolakları, bir tür nöromodülatör olan dopamin sistemini oluşturur. Bu dopaminerjik hücre grupları ilk olarak 1964'te Annica Dahlström ve Kjell Fuxe tarafından şema haline getirilmiştir. Bu gurplara "A" harfi ile başlayan etiketler verilmiştir. Şemalarında, A1'den A7'ye kadar olan alanlar noradrenalin yolaklarını içerirken, A8'den A14'e kadar olan alanlar dopamin yolaklarını içerir.[17]
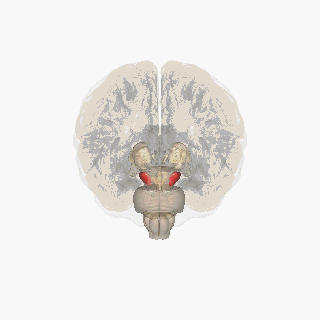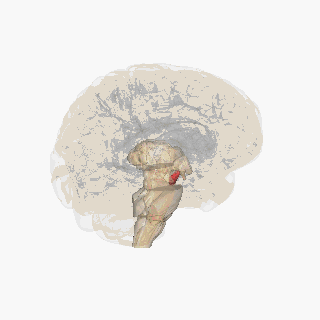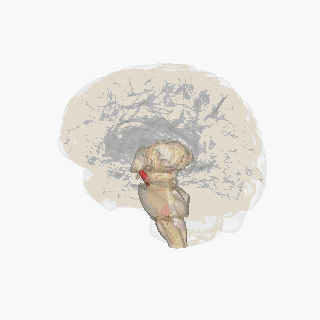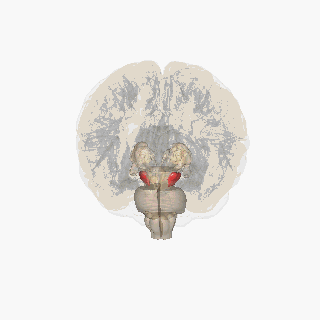
Dopaminerjik nöronlar (dopamin üreten sinir hücreleri) nispeten az bir miktarda bulunur. İnsan beyninde toplamda 400.000 civarında dopaminerjik nöron bulunur.[18] Ancak bu nöronların aksonları beynin diğer birçok bölgesine uzanır ve hedefleri üzerinde güçlü etkiler gösterirler.[19] Günümüzde bilim adamlarının tanımladığı dopaminerjik alanlar, substantia nigra (kara madde, A8 ve 19), ventral tegmental alan (A10), arka hipotalamus (A11), arkuat nukleus (yaysı nukleus, A12), zona incerta (A13) ve periventriküler nukleus (A14)'tur.[17]
Substantia nigra
Substantia nigra, bazal ganglionun bir parçası olan küçük bir orta beyin bölgesidir. Substantia nigra, pars kompakta ve pars reticulata olmak üzere ikiye ayrılır. Dopaminerjik nöronlar esas olarak pars kompaktada (A8) ve pars kompaktanın yakınlarında (A9) bulunur.[19] İnsanlarda, dopaminerjik nöronların pars kompaktadan dorsal striatuma projeksiyonu (nigrostriatal yolak), motor fonksiyonlarının kontrolünde ve yeni motor becerilerin öğrenilmesinde önemli bir rol oynar.[5]
Ventral tagmental alan
Ventral tegmental alan (VTA), bir orta beyin bölgesidir. VTA dopaminerjik nöronların en belirgin grubu mezokortikal yolak aracılığıyla prefrontal kortekse projekte olur. Başka bir küçük grup ise mezolimbik yolak aracılığıyla nükleus akumbense projekte olur. Birlikte, bu iki yolak mezokortikolimbik projeksiyon olarak adlandırılır. VTA ayrıca amigdala, singulat korteks, hipokampus ve olfaktör bulbusa dopaminerjik projeksiyonlar gönderir.[5][19] Mezokortikolimbik nöronlar, ödül sisteminde merkezi bir rol oynar.[19] Günümüzdeki araştırmalar, dopaminin bir dizi beyin bölgesi üzerindeki etkileri sayesinde itici uyaranlara karşı koşullanmada (deneyim yolu ile zararlı olduğu öğrenilmiş aktivitelerden uzak durma) çok önemli bir rol oynadığını göstermektedir.[20][21][22]
Hipotalamus
Arka hipotalamusta omuriliğe sinyal gönderen dopaminerjik nöronlar vardır, fakat dopaminin bu bölgedeki işlevi tam olarak bilinmemektedir. Bu alandaki patolojinin huzursuz bacak sendromunda rol oynadığına dair bazı kanıtlar vardır.[23]
Hipotalamusta bulunan arkuat nukleus ve periventriküler nukleus, dopaminerjik bir yolak olan tuberoinfundibular yolak aracılığı ile hipofiz bezine giderek prolaktin hormonunun salgılanmasını inhibe eder. Dopamin, prolaktin salgılanmasının birincil nöroendokrin inhibitörüdür.[24] Prolaktin sekresyonunu inhibe etmesi bağlamında, dopamin, bazen prolaktin inhibe edici faktör, prolaktin inhibe edici hormon veya prolaktostatin olarak adlandırılır.[24]
Arkuat ve periventriküler nukleus arasında gruplanan zona incerta, hipotalamusun çeşitli bölgelerine sinyal gönderir. Ergenlik döneminde erkek ve dişi üreme sistemlerinin gelişimini aktive etmek için gerekli olan gonadotropin salgılatıcı hormonun (GnRH) salınımını kontrol eder.[24]
Bazal ganglion

Omurgalıların beynindeki en büyük ve en önemli dopamin kaynakları, substantia nigra ve ventral tegmental bölgedir. Bu yapılar birbirleriyle yakından ilişkilidir ve birçok yönden işlevsel olarak benzerdirler. Her ikisi de orta beyinde yer alır.[19] Bazal gangliyonun en büyük bileşeni striatumdur.[25] Substantia nigra, dorsal striatuma dopaminerjik sinyal gönderirken ventral tegmental alan, ventral striatuma benzer tipte bir dopaminerjik sinyal gönderir.[19]
Bazal ganglionun işlevleri günümüzde henüz tam olarak anlaşılamamıştır.[19] Genel olarak kabul gören en popüler hipotezler, bazal ganglionun eylem seçiminde temel bir rol oynadığını öne sürer.[26] Eylem seçilim teorisi, en basit haliyle, bir canlının birkaç davranışın mümkün olduğu bir durumda olduğunda, bazal ganglionun bu davranışlardan hangisinin gerçekleştirileceğini belirlediğini öne sürer. Bu teoriye göre bazal ganglion, davranışları başlatmaktan sorumludur. Ancak bu davranışların eyleme nasıl geçirileceğinin ayrıntılarını belirlemekten sorumlu değildir. Başka bir deyişle, bazal ganglion, esasen bir karar verme sistemi oluşturur.[27]
Bazal ganglion birkaç bölüme ayrılabilir. Bu bölümlerden her biri belirli türdeki eylemlerin kontrolünde yer alır.[28] Bazal ganglionun ventral bölümü (ventral striatum ve ventral tegmental alanı içerir), tüm organizma düzeyinde eylemleri seçerek hiyerarşinin en üst düzeyinde çalışır.[27] Dorsal bölümler (dorsal striatum ve substantia nigra'yı içerir) belirli bir davranış kalıbını uygulamak için kullanılan belirli kasları ve hareketleri seçerek daha düşük bir hiyerarşide çalışır.[28]
Dopamin, eylem seçim sürecine iki önemli yolla katkıda bulunur. İlk olarak, eylemleri başlatmak için "eşiği" belirler.[26] Dopamin aktivitesinin seviyesi ne kadar yüksekse, belirli bir davranışı uyandırmak için gereken itici güç o kadar düşük olur.[26] Sonuç olarak, yüksek düzeyde dopamin, hiperrefleksiye ve dürtüsel (impulsif) davranışa yol açar; düşük dopamin seviyeleri uyuşukluk ve yavaşlamış yanıtlara yol açar.[26] Parkinson hastalığı, substantia nigra devresindeki dopamin seviyelerinin büyük ölçüde azalmasına sebep olur. Bu hastalığı taşıyan kişilerde fiziksel olarak harekete geçmekte zorluk görülür. Ancak, hastalığı olan kişiler ciddi bir tehdit gibi güçlü uyaranlarla karşı karşıya kaldıklarında, tepkileri sağlıklı bir insanınkı kadar şiddetli olabilir.[29] Zıt olarak, metilfenidat veya amfetamin gibi dopamin salınımını artıran ilaçlar, yüksek aktivite seviyeleri üretebilir. Yüksek dozlarda bu ilaçlar, psikomotor ajitasyon ve sterotipik hareketlere sebep olabilir.[30]
Dopaminin ikinci önemli etkisi “öğretici” bir sinyal olmasıdır. Bir eylemi gerçekleştirirken dopamin aktivitesinde bir artış olursa, bazal ganglionun nöral ağları (network), gelecekte benzer durumlar ortaya çıktığında aynı yanıtı uyandırmayı kolaylaştıracak şekilde değişime uğrar.[26]
Ödül
Ödül sistemini tartışmak için kullanılan dilde "ödül", arzu etme (isteme) ve beğenme (zevk alma) davranışına neden olan bir uyarıcının çekici ve motivasyonel özelliğidir.[31] Ödüllendirici bir uyaran, canlıyı onu istemeye ve onu gerçekleştirmeyi seçmeye teşvik edebilen bir uyarandır. Zevk, öğrenme (örneğin, klasik ve edimsel koşullanma) ve yaklaşma (isteme ve arzu etme) davranışı, ödülün üç ana işlevidir.[31] Ödülün bir yönü olarak "zevk", ödülün bir tanımını sağlar; ancak, tüm zevkli uyaranlar ödüllendirici olsa da, tüm ödüllendirici uyaranlar zevkli değildir (örnek: para gibi dışsal ödüller).[31][32] Ödüllendirici uyaranların motivasyonel veya arzu edilen yönü, ödülün ortaya çıkardığı isteme hissiyatından kaynaklanırken, içsel ödüllerden (çekici olan ve doğası gereği zevkli oldukları için davranışı motive eden koşulsuz ödüller) alınan zevk, ödülü aldıktan sonra tüketmekten kaynaklanır.[31] "Incentive salience" adında bir nöropsikolojik model, içsel olarak ödüllendirici bir uyaranın bu iki bileşenini birbirinden ayırır. Bu modelde istemek veya arzu, "yaklaşma" davranışına karşılık gelirken, beğenme veya haz (zevk), "tamamlayıcı" davranışa karşılık gelir.[5][31][33] Örnek olarak, uyuşturucu bağımlısı olan insanlarda, bağımlılık yapan bir maddeyi kullanma arzusu arttıkça "yaklaşma" kavramı ile "tamamlayıcı" kavramı birbirinden ayrışır; uyuşturucuya karşı gelişen tolerans nedeniyle onu tüketmekten elde edilen zevk azalır.[5]
Merkezi sinir sisteminin dışında
Dopamin kan-beyin bariyerini geçmez, bu nedenle periferik alanlardaki sentezi ve işlevleri, beyindeki sentezinden ve işlevlerinden büyük ölçüde bağımsızdır.[34] Kanda önemli miktarlarda dopamin dolaşır, ancak dopaminin buradaki işlevleri tam olarak bilinmemektedir.[35] Dopamin, kan plazmasında epinefrin ile benzer miktarlarda bulunur, ancak insanlarda, plazmadaki dopaminin %95'inden fazlası, dopamin sülfat formundadır. Bunun sebebi kanda serbest dolaşan dopaminin sülfotransferaz 1A3/1A4 enzimleri tarafından katalize edilmesidir. Dopamin sülfatın bilinen hiçbir biyolojik işlevi yoktur ve idrarla vücuttan atılır.[35]
Dopamin, periferik dokulardaki dopamin reseptörlerine etki edebilir veya dopamin beta hidroksilaz enzimi tarafından norepinefrine dönüştürülebilir.[35] Bazı atardamar duvarlarında dopamin reseptörleri bulunur. Dopaminin bu reseptörlere bağlanması nöradrenalinin salınımını engelleyerek vazodilatasyona sebep olur.[36]
Bağışıklık sistemi
Bağışıklık sisteminde dopamin, bağışıklık hücrelerine, özellikle lenfositlerde bulunan reseptörlere etki eder.[37] Ayrıca dopamin, dalak, kemik iliği ve dolaşım sistemindeki bağışıklık hücrelerini de etkileyebilir.[38] Ek olarak, dopamin, bağışıklık hücrelerinin kendileri tarafından sentezlenebilir.[37] Dopaminin lenfositler üzerindeki ana etkisi, aktivasyon seviyelerini azaltmaktır. Bu sistemin işlevsel önemi belirsizdir, ancak bu sistem sinir sistemi ve bağışıklık sistemi arasındaki etkileşimler için olası bir yol sağlar ve bazı otoimmün bozukluklardan sorumlu olabilir.[38]
Böbrekler
Renal dopaminerjik sistemi, tüm dopamin reseptör alt tiplerinin bulunduğu nefron hücrelerinde bulunur.[39] Dopamin böbreklerde tübül hücreleri tarafından sentezlenir ve tübüler sıvıya salınır. Fonksiyonları arasında böbreklere kan akışını artırmak, glomerüler filtrasyon hızını artırmak ve idrarda sodyum atılımını artırmak yer alır. Bu nedenle, renal dopamin fonksiyonundaki bozukluklar, sodyum atılımının azalmasına ve sonuç olarak hipertansiyona neden olabilir.[40]
Pankreas
Pankreasta dopaminin rolü karmaşıktır. Pankreas, ekzokrin ve endokrin bileşen olmak üzere iki bölümden oluşur. Ekzokrin kısım, sindirim enzimlerini ve dopamin de dahil olmak üzere diğer bazı maddeleri sentezler ve ince bağırsağa salgılar. Salgılanan bu dopaminin ince bağırsağa girdikten sonraki işlevi tam olarak bilinmemektedir. Bilim insanlarının bu konuda hipotezleri, dopaminin bağırsak mukozasını hasardan koruduğu ve gastrointestinal motiliteyi azalttığı yönündedir.[41]
Pankreasın endokrin kısmı, insülin dahil olmak üzere bazı hormonları sentezler ve kan dolaşımına salgılar. İnsülini sentezleyen kısımlardaki beta hücrelerinin dopamin reseptörleri içerdiğine ve dopaminin bu hücrelerin inüsülin sentezini azalttığı yönünde kanıtlar vardır.[41] Bu bölgedeki dopaminin kaynağı net olarak belirlenmemiştir; kan dolaşımında dolaşan ve sempatik sinir sisteminden türetilen dopaminden gelebilir veya diğer pankreas hücreleri tarafından lokal olarak sentezlenebilir.[41]
Hastalıklar, bozukluklar ve farmakoloji
Dopamin; Parkinson hastalığı (PD), Huntington hastalığı, fibromiyalji, dikkat eksikliği ve hiperaktivite bozukluğu (DEHB), huzursuz bacak sendromu, madde kullanım bozuklukları, bipolar bozukluk, obsesif-kompulsif bozukluk (OKB), majör depresif bozukluk ve şizofreni gibi birçok önemli tıbbi durumda merkezi bir rol oynar. Dopaminin kendisinin dışında, beynin veya vücudun çeşitli bölgelerindeki dopamin sistemlerine etki eden başka birçok önemli ilaç vardır, bunlara dopamin geri alım inhibitörleri ve antipsikotikler örnek verilebilir.
Multipl skleroz
Çalışmalar, dopamin dengesizliğinin multipl sklerozda görülen yorgunluğa neden olduğunu öne sürmektedir.[42] Multipl sklerozlu hastalarda dopamin, periferik kan mononükleer hücreleri tarafından IL-17 ve IFN-γ üretimini engeller.[43]
Parkinson hastalığı ve L-DOPA
Parkinson hastalığı, kaslarda sertlik, hareketin yavaşlaması ve kullanılmadığında bacakların titremesi gibi hareket bozuklukları ile karakterize edilen, yaşa bağlı bir hastalıktır. İleri evrelerde demansa, ardından da ölüme kadar ilerleyebilir.[29] Bu hastalığın ana semptomları, substantia nigra'daki dopamin salgılayan hücrelerin kaybından kaynaklanır.[44] Bu dopamin hücreleri özellikle hasara karşı savunmasızdır. Ensefalit (beyin iltihabı) ve tekrarlanan beyin sarsıntıları (hafif travmatik beyin hasarı) gibi fiziksel darbeler veya MPTP gibi bazı kimyasal zehirlenme biçimleri yüksek oranlarda dopaminerjik hücre kaybına neden olabilir. Bu, Parkinson hastası olmayan kişilerde Parkinsonizme yol açabilir.[45]
Parkinsonizm için en yaygın kullanılan tedavi, dopaminin metabolik öncüsü olan L-DOPA'dır.[34] L-DOPA, beyinde ve vücudun çeşitli bölgelerinde DOPA dekarboksilaz enzimi tarafından dopamine dönüştürülür.[46] Tedavide dopamin yerine L-DOPA'nın kullanılmasının sebebi L-DOPA'nın dopaminden farklı olarak kan-beyin bariyerini geçebilmesidir.[34]
L-DOPA tedavisi, kaybolan dopamin hücrelerini geri getiremez, ancak kalan hücrelerin daha fazla dopamin üretmesine neden olur, böylece kaybı en azından bir dereceye kadar telafi eder. Fakat hastalığın ileri evrelerinde tedavi başarısız olmaya başlar. Çünkü hücre kaybı o kadar şiddetlidir ki, kalan hücreler L-DOPA seviyelerinden bağımsız olarak yeterli dopamin üretme kapasitesine sahip değildir. Bromokriptin, pergolid ve monoamin oksidaz inhibitörleri gibi dopamin işlevini artıran diğer ilaçlar da bazen Parkinsonizmi tedavi etmek için kullanılır, ancak çoğu durumda L-DOPA, olumlu etkiler ve olumsuz yan etkiler arasında en iyi dengeyi sağlamaktadır.[34]
Dikkat eksikliği ve hiperaktivite bozukluğu
Bozulan dopamin nörotransmiysonu, bozulmuş bilişsel kontrol ile ilişkili bir durum olan dikkat eksikliği ve hiperaktivite bozukluğu (DEHB) ile ilişkilidir.[5] DEHB, dikkat eksikliği, impulsif davranışlar ve bir şeyleri unutma veya detayları kaçırma (işleyen hafıza problemleri) dahil olmak üzere birçok farklı probleme yol açar.[47] Diğer nörotransmitter reseptörleri ve taşıyıcıları ile bağlantılara ek olarak, dopamin reseptörleri, dopamin taşıyıcısı ve DEHB arasında genetik bağlantılar vardır.[48] Dopamin ve DEHB arasındaki en önemli ilişki, DEHB tedavisinde kullanılan ilaçlardır.[49] DEHB için en sık kullanılan ilaçlar olan metilfenidat (Ritalin, Concerta) ve amfetamin/dextroamfetamin (Evekeo, Adderall, Dexedrine) gibi psikostimülanlar, beyinde hem dopamin hem de norepinefrin düzeylerini arttırarak çalışırlar.[50]
Madde bağımlılığı ve psikostimülanlar
Kokain, metamfetamin, amfetamin/dekstroamfetamin (Adderall), metilfenidat gibi psikostimulanlar, çeşitli mekanizmalar yoluyla beyindeki dopamin seviyelerini esas olarak veya kısmen artırarak etkilerini gösterirler.[51] Kokain ve metilfenidat, dopamin birer dopamin geri alım inhibitörüdür.[52] Bu moleküller dopamin geri alımını inhibe ederek sinaptik boşlukta bulunan dopamin miktarının artmasına neden olur.[53][54] Kokain gibi, metamfetamin ve amfetamin de sinaptik boşlukta bulunan dopamin miktarını arttırır, ancak bunu farklı mekanizmalar ile gerçekleştirirler.[54][55]
Psikostimulanların etkileri arasında kalp atış hızında artış, vücut ısısı ve terlemedeki artışlar; uyanıklık, dikkat ve dayanıklılıkta artış ve aktivitelerden alınan zevkte artış bulunur. Ancak daha yüksek dozlarda ajitasyon, anksiyete ve hatta gerçeklikle temas kaybı (derealizasyon) meydana gelebilir. Bu gruptaki ilaçlar, beyindeki dopamin ödül sistemi üzerindeki aktive edici etkileri nedeniyle yüksek bir bağımlılık potansiyeline sahiptir.[51] Ancak bazıları, düşük dozlarda, dikkat eksikliği hiperaktivite bozukluğu (DEHB) ve narkolepsi tedavisinde kullanılır.[56][57]
Çeşitli bağımlılık yapan ilaçlar, ödülle ilgili dopamin aktivitesinde bir artış sağlar.[51] Nikotin, kokain ve metamfetamin gibi stimülanların dopamin üzerindeki etkileri, bu maddelerin bağımlılık yapmasının ana sebebi olarak kabul edilir. Bir opioid olan heroin gibi diğer bağımlılık yapan ilaçlar için, artan dopamin seviyeleri bağımlılıkta sadece ufak bir rol oynamaktadır.[58] Psikostimulanlara bağımlı kişiler yoksunluk durumunda, alkol yoksunluğu veya opioid yoksunluğunda görülen fiziksel semptomları yaşamazlar. Bunun yerine, psikolojik bağımlılığın neden olduğu irratibilite, huzursuzluk ve diğer uyarılma semptomları ile karakterize edilen maddeyi kullanmaya yönelik yönelik yoğun bir arzu, özlem yaşarlar.[59]
Dopamin sistemi, bağımlılığın çeşitli yönlerinde çok önemli bir rol oynar. En erken aşamada, beyindeki dopamin reseptörlerinin ifadesini değiştiren genetik farklılıklar, bir kişinin psikostimülanları çekici mi yoksa itici mi bulacağına karar verir.[60] Tekrarlayan yüksek doz psikostümilan tüketiminin sebep olduğu dopamin seviyelerindeki kronik artış, beyinde fiziksel olarak değişime neden olur.[61] Psikostümilan bağımlılığının tedavisi çok zordur, çünkü kullanım dursa bile psikolojik olarak geri çekilmeyle gelen yoğun madde kullanma isteği azalmaz.[60]
Psikotik bozukluklar ve antipsikotikler
1950'lerin başında psikiyatristler, tipik antipsikotikler olarak bilinen bir ilaç sınıfının, şizofreninin psikotik semptomlarını azaltmada genellikle etkili olduğunu keşfetmişlerdir. İlk yaygın olarak kullanılan antipsikotik klorpromazinin piyasaya sürülmesi, takip eden yıllarda birçok şizofreni hastasının akıl hastanelerinden taburcu olmasını sağladı.[62] 1970'lerde araştırmacılar, tipik antipsikotiklerin Dopamin D2 reseptörlerini antagonize ederek çalıştığını anlamışlardır.[63] Bu olay, şizofreninin büyük ölçüde beyin dopamin sistemlerinin hiperaktivitesinden kaynaklandığını öne süren şizofreninin dopamin hipotezinin ortaya atılmasına neden olmuştur.[64] Dopamin hipotezi, psikotik semptomların metamfetamin gibi dopamini artıran uyarıcılar tarafından sıklıkla yoğunlaştırıldığı ve bu ilaçların yeterince yüksek dozlarda alındığında sağlıklı insanlarda da psikoza neden olabildiğinden destek almıştır.[64] Sonraki yıllarda, daha az ciddi yan etkiye sahip olan ve diğer nörotransmitterler üzerinde de etkisi olan atipik antipsikotikler piyasaya sürülmüştür.[62] Bu yeni nesil antipsikotiklerin çoğu dopaminin aktivitesini direkt olarak engellemez, bunun yerine dopamin aktivitesinde değişiklikler meydana getirirler.[65]
İlerleyen dönemlerdeki araştırmalar, psikozun sadece dopaminden çok daha fazla faktör ile ilişkili olduğunu ortaya koymuştur. Bu, dopamin teorisinin yetersiz bir teori olduğunu ortaya çıkarmıştır. Şizofreni hastaları genellikle dopamin aktivitelerinde ölçülebilir bir artış göstermezler.[64] Buna rağmen, antipsikotiklerin etkili olması dopaminin psikozun ana sebebi olmasa da psikoz üzerinde dolaylı bir etkisi olduğunu göstermektedir.[62] Antipsikotiklerin neden çalıştığı ve psikozun neyden kaynaklandığı, hala psikiyatristler ve sinirbilimciler arasında bir tartışma konusudur.[66]
Şizofreninin yanı sıra antipsikotikler, bipolar bozukluk ve psikotik depresyon ve bazı kişilik bozuklukları gibi birçok psikotik bozukluğun tedavisinde kullanılır.[67]
Majör depresif bozukluk ve dopaminerjik antidepresanlar
Majör Depresif Bozukluk (MDD), dünya çapında en yaygın görülen mental bozukluklardan biridir.[68] Her ne kadar günümüzde depresyonun ilk basamak tedavisinde kullanılan ilaçlar dopamin üzerinde bir etki göstermese de, bütün monoamin nörotransmitterlerin (nöradrenalin, dopamin ve serotonin) depresyon üzerinde etkisi olduğu bilinmektedir. Günümüzde, MDD için onaylanmış antidepresanların çoğu, monoaminerjik mekanizmalar yoluyla hareket etmektedir. Trisiklik antidepresanlar (TCA'lar) ve monoamin oksidaz inhibitörleri (MAO'lar) gibi birinci nesil antidepresanlar, serotonin ve norepinefrin monoaminlerinin geri alımını, metabolizmasını veya reseptör farmakodinamiğini değiştirir. Ayrıca, MAO inhibitörleri dopamin metabolizmasını inhibe ederek beyindeki dopamin miktarını arttırır. Birinci nesil antidepresanlardan daha az yan etkiye sahip olan ikinci nesil antidepresanlar, seçici serotonin geri alım inhibitörleri (SSRI'lar) ve serotonin-norepinefrin geri alım inhibitörleri gibi ilaçlarla monoaminerjik sinir iletimini hedefler. SSRI'ların birinci nesil ajanlara kıyasla daha az yan etkiye sahip olmaları ve çok daha iyi tolare edilmelerine rağmen etkinlikleri sınırlıdır.[69]
Anhedoni (bireysel motivasyon ve haz alabilme seviyesinin/kabiliyetinin düşmesi/kaybı), Parkinson hastalığı ve şizofreni gibi çeşitli dopamin ile ilişkili mental ve norödejeneratif bozuklukta görülen bir semptomdur ve depresyonda da görülür. Günümüzdeki araştırmalar, SSRI'lar gibi ikinci nesil antidepresanların, depresyonda motivasyon ve ödülle ilgili bilişsel bozulma gibi anhedoni semptomlarının tedavisinde etkili olmadığını ortaya koymuştur. Anhedoninin yalnızca zevk alma yeteneğinin kaybı olarak tanımlanmadığını, aynı zamanda ödül almayla ilgili beklenti, motivasyon ve karar verme süreçlerinin bozulmasını kapsadığını belirtmek önemlidir. Bunlar, ödül sisteminde potansiyel bir bozukluğun göstergesidir. Bu, ödül sisteminin ana modülatör molekülü olan dopaminin işlevinde bir bozukluğa işaret eder. Tarihsel olarak depresyon, her ne kadar serotonin (5-HT) ve norepinefrin içeren sinir ağlarının işlev bozuklukları ile ilişkilendirilmiş olsa da, günümüzdeki modern tekniklerin yardımı ile, depresyonda olan kişilerin dopamin sisteminde de işlev bozuklukları olduğu anlaşılmıştır. Ayrıca, anhedonisi olan depresif hastalarda, PET görüntüleme çalışmaları, sağlıklı deneklere kıyasla önemli ölçüde daha az dopamin taşıyıcısı (DAT) aktivitesi tespit etmiştir, bu da dopamin seviyelerinde bir düşüş olduğunu düşündürmektedir.[69]
Günümüzde her ne kadar en sık kullanılan antidepresanlar SSRI'lar olsa da, bu ilaçların etki göstermemesi durumunda diğer monoaminler üzerinde etkisi olan ilaçlar kullanılabilir. Bu ilaçlardan bazıları dopamin seviyelerini direkt olarak veya dolaylı yollardan arttırarak çalışır. Bunlara örnek olarak dopamin-nörepinefrin geri alım inhibitörü bupropion ve N-metil-d-aspartat antagonisti ketamin örnek verilebilir. Dopaminin etkisini arttıran bu ilaçlar, anhedoninin azalması için etkilidir.[69] Bununla birlikte, amfetamin gibi bazı dopaminejrik psikostimülanların depresyonun tedavisinde etkili olabileceği düşünülmektedir.[70]
Kimyasal yapısı
Dopamin molekülü, etil zinciri yoluyla birbirine bağlı bir amin grubu ile bir katekol yapısından (iki hidroksil yan grubuna sahip bir benzen halkası) oluşur.[1] Dopamin, nörotransmiterler norepinefrin ve adrenalini de içeren bir familya olan katekolaminlerin mümkün olan en basit halidir.[71] Amin eki ile bir benzen halkasının varlığı, dopamini bir ikame edilmiş feniletilamin yapar.[72] Çoğu amin gibi, dopamin de organik bir bazdır.[10]


Kaynakça
- ^ a b PubChem. "Dopamine". pubchem.ncbi.nlm.nih.gov (İngilizce). 7 Eylül 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Ekim 2022.
- ^ "Dopamine: What It Is, Function & Symptoms". Cleveland Clinic. 17 Nisan 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Ekim 2022.
- ^ Berridge, Kent C. (1 Nisan 2007). "The debate over dopamine's role in reward: the case for incentive salience". Psychopharmacology (İngilizce). 191 (3): 391-431. doi:10.1007/s00213-006-0578-x. ISSN 1432-2072.
- ^ Wise, Roy A.; Robble, Mykel A. (4 Ocak 2020). "Dopamine and Addiction". Annual Review of Psychology (İngilizce). 71 (1): 79-106. doi:10.1146/annurev-psych-010418-103337. ISSN 0066-4308. 6 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ a b c d e f Nestler, Eric J. (2009). Molecular neuropharmacology : a foundation for clinical neuroscience. 2nd ed. Steven E. Hyman, Robert C. Malenka. New York: McGraw-Hill Medical. ISBN 978-0-07-164119-7. OCLC 273018757.
- ^ Baliki, Marwan N.; Mansour, Ali; Baria, Alex T.; Huang, Lejian; Berger, Sara E.; Fields, Howard L.; Apkarian, A. Vania (9 Ekim 2013). "Parceling Human Accumbens into Putative Core and Shell Dissociates Encoding of Values for Reward and Pain". Journal of Neuroscience (İngilizce). 33 (41): 16383-16393. doi:10.1523/JNEUROSCI.1731-13.2013. ISSN 0270-6474. PMC 3792469 $2. PMID 24107968.
- ^ Wenzel, Jennifer M.; Rauscher, Noah A.; Cheer, Joseph F.; Oleson, Erik B. (21 Ocak 2015). "A Role for Phasic Dopamine Release within the Nucleus Accumbens in Encoding Aversion: A Review of the Neurochemical Literature". ACS Chemical Neuroscience (İngilizce). 6 (1): 16-26. doi:10.1021/cn500255p. ISSN 1948-7193. PMC 5820768 $2. PMID 25491156. 23 Kasım 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ Puglisi-Allegra, Stefano; Ventura, Rossella (2012). "Prefrontal/accumbal catecholamine system processes high motivational salience". Frontiers in Behavioral Neuroscience. 6. doi:10.3389/fnbeh.2012.00031. ISSN 1662-5153. PMC 3384081 $2. PMID 22754514.
- ^ "Dopamine: What It Does for You and Related Conditions". Verywell Health (İngilizce). 11 Kasım 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Ekim 2022.
- ^ a b c Carter JE, Johnson JH, Baaske DM (1982). "Dopamine Hydrochloride, Analytical Profiles of Drug Substances". ScienceDirect. 4 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ a b c Grandy, David K.; Miller, Gregory M.; Li, Jun-Xu (1 Şubat 2016). ""TAARgeting Addiction"—The Alamo Bears Witness to Another Revolution: An Overview of the Plenary Symposium of the 2015 Behavior, Biology and Chemistry Conference". Drug and Alcohol Dependence (İngilizce). 159: 9-16. doi:10.1016/j.drugalcdep.2015.11.014. ISSN 0376-8716. PMC 4724540 $2. PMID 26644139.
- ^ a b c d e The dopamine receptors. 2nd ed. Kim A. Neve. New York: Humana Press. 2010. ISBN 978-1-60327-333-6. OCLC 567352997.
- ^ a b Eiden, Lee E.; Schäfer, Martin K.-H.; Weihe, Eberhard; Schütz, Burkhard (1 Şubat 2004). "The vesicular amine transporter family (SLC18): amine/proton antiporters required for vesicular accumulation and regulated exocytotic secretion of monoamines and acetylcholine". Pflügers Archiv (İngilizce). 447 (5): 636-640. doi:10.1007/s00424-003-1100-5. ISSN 1432-2013.
- ^ a b Beaulieu, Jean-Martin; Gainetdinov, Raul R. (1 Mart 2011). "The Physiology, Signaling, and Pharmacology of Dopamine Receptors". Pharmacological Reviews (İngilizce). 63 (1): 182-217. doi:10.1124/pr.110.002642. ISSN 0031-6997. PMID 21303898. 9 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ Torres, Gonzalo E.; Gainetdinov, Raul R.; Caron, Marc G. (Ocak 2003). "Plasma membrane monoamine transporters: structure, regulation and function". Nature Reviews Neuroscience (İngilizce). 4 (1): 13-25. doi:10.1038/nrn1008. ISSN 1471-0048. 29 Eylül 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ Jaber, M.; Robinson, S. W.; Missale, C.; Caron, M. G. (1996). "Dopamine receptors and brain function". Neuropharmacology. 35 (11): 1503-1519. doi:10.1016/s0028-3908(96)00100-1. ISSN 0028-3908. PMID 9025098. 7 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ a b Dahlstroem, A.; Fuxe, K. (1964). "EVIDENCE FOR THE EXISTENCE OF MONOAMINE-CONTAINING NEURONS IN THE CENTRAL NERVOUS SYSTEM. I. DEMONSTRATION OF MONOAMINES IN THE CELL BODIES OF BRAIN STEM NEURONS". Acta Physiologica Scandinavica. Supplementum: SUPPL 232:1-55. ISSN 0302-2994. PMID 14229500. 7 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ Schultz, Wolfram (1 Temmuz 2007). "Multiple Dopamine Functions at Different Time Courses". Annual Review of Neuroscience (İngilizce). 30 (1): 259-288. doi:10.1146/annurev.neuro.28.061604.135722. ISSN 0147-006X. 7 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ a b c d e f g Björklund, Anders; Dunnett, Stephen B. (1 Mayıs 2007). "Dopamine neuron systems in the brain: an update". Trends in Neurosciences (İngilizce). 30 (5): 194-202. doi:10.1016/j.tins.2007.03.006. ISSN 0166-2236. PMID 17408759. 16 Ekim 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ Fadok, Jonathan P.; Dickerson, Tavis M. K.; Palmiter, Richard D. (9 Eylül 2009). "Dopamine Is Necessary for Cue-Dependent Fear Conditioning". Journal of Neuroscience (İngilizce). 29 (36): 11089-11097. doi:10.1523/JNEUROSCI.1616-09.2009. ISSN 0270-6474. PMC 2759996 $2. PMID 19741115. 9 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ Tang, Wei; Kochubey, Olexiy; Kintscher, Michael; Schneggenburger, Ralf (13 Mayıs 2020). "A VTA to Basal Amygdala Dopamine Projection Contributes to Signal Salient Somatosensory Events during Fear Learning". Journal of Neuroscience (İngilizce). 40 (20): 3969-3980. doi:10.1523/JNEUROSCI.1796-19.2020. ISSN 0270-6474. PMC 7219297 $2. PMID 32277045. 9 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ Jo, Yong S.; Heymann, Gabriel; Zweifel, Larry S. (21 Kasım 2018). "Dopamine Neurons Reflect the Uncertainty in Fear Generalization". Neuron (İngilizce). 100 (4): 916-925.e3. doi:10.1016/j.neuron.2018.09.028. ISSN 0896-6273. PMC 6226002 $2. PMID 30318411.
- ^ Paulus, Walter; Schomburg, Eike D. (1 Haziran 2006). "Dopamine and the spinal cord in restless legs syndrome: Does spinal cord physiology reveal a basis for augmentation?". Sleep Medicine Reviews (İngilizce). 10 (3): 185-196. doi:10.1016/j.smrv.2006.01.004. ISSN 1087-0792. 7 Kasım 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ a b c Ben-Jonathan N, Hnasko R. "Dopamine as a Prolactin (PRL) Inhibitor". Endocrine Reviews. Oxford Academic. doi:10.1210/er.22.6.724. 3 Haziran 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ Fix, James D. (2008). Neuroanatomy. 4th ed. Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins. ISBN 978-0-7817-7245-7. OCLC 85817989.
- ^ a b c d e Chakravarthy, V. S.; Joseph, Denny; Bapi, Raju S. (1 Eylül 2010). "What do the basal ganglia do? A modeling perspective". Biological Cybernetics (İngilizce). 103 (3): 237-253. doi:10.1007/s00422-010-0401-y. ISSN 1432-0770.
- ^ a b Floresco, Stan B. (3 Ocak 2015). "The Nucleus Accumbens: An Interface Between Cognition, Emotion, and Action". Annual Review of Psychology (İngilizce). 66 (1): 25-52. doi:10.1146/annurev-psych-010213-115159. ISSN 0066-4308. 5 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ a b Balleine, Bernard W; Dezfouli, Amir; Ito, Makato; Doya, Kenji (1 Ekim 2015). "Hierarchical control of goal-directed action in the cortical–basal ganglia network". Current Opinion in Behavioral Sciences. Neuroeconomics (İngilizce). 5: 1-7. doi:10.1016/j.cobeha.2015.06.001. ISSN 2352-1546. 7 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ a b Jankovic, J. (1 Nisan 2008). "Parkinson's disease: clinical features and diagnosis". Journal of Neurology, Neurosurgery & Psychiatry (İngilizce). 79 (4): 368-376. doi:10.1136/jnnp.2007.131045. ISSN 0022-3050. PMID 18344392. 7 Haziran 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ Pattij, Tommy; Vanderschuren, Louk J. M. J. (1 Nisan 2008). "The neuropharmacology of impulsive behaviour". Trends in Pharmacological Sciences (İngilizce). 29 (4): 192-199. doi:10.1016/j.tips.2008.01.002. ISSN 0165-6147. PMID 18304658. 10 Ekim 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ a b c d e Schultz, Wolfram (1 Temmuz 2015). "Neuronal Reward and Decision Signals: From Theories to Data". Physiological Reviews. 95 (3): 853-951. doi:10.1152/physrev.00023.2014. ISSN 0031-9333. PMC 4491543 $2. PMID 26109341. 3 Eylül 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ Robinson, Terry E.; Berridge, Kent C. (1 Eylül 1993). "The neural basis of drug craving: An incentive-sensitization theory of addiction". Brain Research Reviews (İngilizce). 18 (3): 247-291. doi:10.1016/0165-0173(93)90013-P. ISSN 0165-0173. 4 Şubat 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ Berridge, Kent C; Robinson, Terry E; Aldridge, J Wayne (1 Şubat 2009). "Dissecting components of reward: 'liking', 'wanting', and learning". Current Opinion in Pharmacology. Neurosciences (İngilizce). 9 (1): 65-73. doi:10.1016/j.coph.2008.12.014. ISSN 1471-4892. PMC 2756052 $2. PMID 19162544. 14 Ekim 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ a b c d National Collaborating Centre for Chronic Conditions (2006). Parkinson's Disease: National Clinical Guideline for Diagnosis and Management in Primary and Secondary Care. Royal College of Physicians (UK). ISBN 9781860162831. OCLC 939595060.
- ^ a b c Eisenhofer, Graeme; Kopin, Irwin J.; Goldstein, David S. (1 Eylül 2004). "Catecholamine Metabolism: A Contemporary View with Implications for Physiology and Medicine". Pharmacological Reviews (İngilizce). 56 (3): 331-349. doi:10.1124/pr.56.3.1. ISSN 0031-6997. PMID 15317907. 6 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ Missale, C.; Nash, S. R.; Robinson, S. W.; Jaber, M.; Caron, M. G. (Ocak 1998). "Dopamine receptors: from structure to function". Physiological Reviews. 78 (1): 189-225. doi:10.1152/physrev.1998.78.1.189. ISSN 0031-9333. PMID 9457173. 7 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ a b Pellicano, Clelia; Pontieri, Francesco E.; Fanciulli, Alessandra; Buttarelli, Francesca R. "The Dopaminergic System in Peripheral Blood Lymphocytes: From Physiology to Pharmacology and Potential Applications to Neuropsychiatric Disorders". Current Neuropharmacology (İngilizce). 9 (2): 278-288. doi:10.2174/157015911795596612. PMC 3131719 $2. PMID 22131937. 6 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ a b Sarkar, Chandrani; Basu, Biswarup; Chakroborty, Debanjan; Dasgupta, Partha Sarthi; Basu, Sujit (1 Mayıs 2010). "The immunoregulatory role of dopamine: An update". Brain, Behavior, and Immunity (İngilizce). 24 (4): 525-528. doi:10.1016/j.bbi.2009.10.015. ISSN 0889-1591. PMC 2856781 $2. PMID 19896530. 7 Kasım 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ Hussain, Tahir; Lokhandwala, Mustafa F. (Şubat 2002). "Renal Dopamine Receptors and Hypertension". Experimental Biology and Medicine (İngilizce). 228 (2): 134-142. doi:10.1177/153537020322800202. ISSN 1535-3702. 6 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ Marcelo Roberto Choi, Nicolá Martí, S; n Kouyoumdzian, Natalia Lucí a Rukavina Mikusic, Marí a Cecilia Kravetz, Marí Iné, A; Rosó, S; N, Martí Rodrí, N; guez Fermepin, Belisario Enrique Ferná ndez (6 Mayıs 2015). "Renal dopaminergic system: Pathophysiological implications and clinical perspectives". World Journal of Nephrology (İngilizce). 4 (2): 196-212. doi:10.5527/wjn.v4.i2.196. PMC 4419129 $2. PMID 25949933. 8 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ a b c Rubí, Blanca; Maechler, Pierre (Aralık 2012). "Minireview: New Roles for Peripheral Dopamine on Metabolic Control and Tumor Growth: Let's Seek the Balance". Endocrinology. 151 (12): 5570-5581. doi:10.1210/en.2010-0745. ISSN 0013-7227.
- ^ Dobryakova, Ekaterina; Genova, Helen M.; DeLuca, John; Wylie, Glenn R. (2015). "The Dopamine Imbalance Hypothesis of Fatigue in Multiple Sclerosis and Other Neurological Disorders". Frontiers in Neurology. 6. doi:10.3389/fneur.2015.00052. ISSN 1664-2295. PMC 4357260 $2. PMID 25814977.
- ^ Marino, Franca; Cosentino, Marco (Nisan 2016). "Repurposing dopaminergic drugs for MS — the evidence mounts". Nature Reviews Neurology (İngilizce). 12 (4): 191-192. doi:10.1038/nrneurol.2016.33. ISSN 1759-4766. 8 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ Parkinson's disease and movement disorders. 5th ed. Joseph Jankovic, Eduardo Tolosa. Philadelphia: Lippincott Williams & Wilkins. 2007. ISBN 0-7817-7881-6. OCLC 70119702.
- ^ Tuite, Paul J.; Krawczewski, Kimberly (Nisan 2007). "Parkinsonism: A Review-of-Systems Approach to Diagnosis". Seminars in Neurology (İngilizce). 27 (02): 113-122. doi:10.1055/s-2007-971174. ISSN 0271-8235. 16 Eylül 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Kasım 2022.
- ^ Handbook of psychopharmacology. Leslie L. Iversen, Susan D. Iversen, Solomon H. Snyder. New York: Plenum Press. 1975-1983. ISBN 978-1-4684-3171-1. OCLC 643778868.
- ^ "Adult attention-deficit/hyperactivity disorder (ADHD) - Symptoms and causes". Mayo Clinic (İngilizce). 14 Ekim 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Ekim 2022.
- ^ Wu, Jing; Xiao, Haifan; Sun, Hongjuan; Zou, Li; Zhu, Ling-Qiang (1 Haziran 2012). "Role of Dopamine Receptors in ADHD: A Systematic Meta-analysis". Molecular Neurobiology (İngilizce). 45 (3): 605-620. doi:10.1007/s12035-012-8278-5. ISSN 1559-1182.
- ^ Berridge, Craig W.; Devilbiss, David M. (15 Haziran 2011). "Psychostimulants as Cognitive Enhancers: The Prefrontal Cortex, Catecholamines, and Attention-Deficit/Hyperactivity Disorder". Biological Psychiatry (İngilizce). 69 (12): e101-e111. doi:10.1016/j.biopsych.2010.06.023. ISSN 0006-3223. PMC 3012746 $2. PMID 20875636.
- ^ "Amphetamine: Meaning, Uses, Side Effects & Types". Cleveland Clinic. 3 Ağustos 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Ekim 2022.
- ^ a b c Ghodse, Hamid (11 Şubat 2010). Ghodse's Drugs and Addictive Behaviour: A Guide to Treatment (İngilizce). Cambridge University Press. ISBN 978-1-139-48567-8. 7 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ Siciliano, Cody A.; Jones, Sara R. (Ağustos 2007). "Cocaine Potency at the Dopamine Transporter Tracks Discrete Motivational States During Cocaine Self-Administration". Neuropsychopharmacology (İngilizce). 42 (9): 1893-1904. doi:10.1038/npp.2017.24. ISSN 1740-634X. PMC 5520781 $2. PMID 28139678. 7 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ Heal, David J.; Pierce, David M. (1 Eylül 2006). "Methylphenidate and its Isomers". CNS Drugs (İngilizce). 20 (9): 713-738. doi:10.2165/00023210-200620090-00002. ISSN 1179-1934.
- ^ a b Freye, E. (2009). Pharmacology and abuse of cocaine, amphetamines, ecstasy and related designer drugs : a comprehensive review on their mode of action, treatment of abuse and intoxication. Dordrecht: Springer. ISBN 978-90-481-2448-0. OCLC 489218895.
- ^ Miller, Gregory M. (Ocak 2011). "The emerging role of trace amine-associated receptor 1 in the functional regulation of monoamine transporters and dopaminergic activity: TAAR1 regulation of monoaminergic activity". Journal of Neurochemistry (İngilizce). 116 (2): 164-176. doi:10.1111/j.1471-4159.2010.07109.x. PMC 3005101 $2. PMID 21073468. 6 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ Kimko, Hui C.; Cross, James T.; Abernethy, Darrell R. (1 Aralık 1999). "Pharmacokinetics and Clinical Effectiveness of Methylphenidate". Clinical Pharmacokinetics (İngilizce). 37 (6): 457-470. doi:10.2165/00003088-199937060-00002. ISSN 1179-1926.
- ^ Mignot, Emmanuel J. M. (1 Ekim 2012). "A Practical Guide to the Therapy of Narcolepsy and Hypersomnia Syndromes". Neurotherapeutics (İngilizce). 9 (4): 739-752. doi:10.1007/s13311-012-0150-9. ISSN 1878-7479. PMC 3480574 $2. PMID 23065655.
- ^ Nutt, David J.; Lingford-Hughes, Anne; Erritzoe, David; Stokes, Paul R. A. (Mayıs 2015). "The dopamine theory of addiction: 40 years of highs and lows". Nature Reviews Neuroscience (İngilizce). 16 (5): 305-312. doi:10.1038/nrn3939. ISSN 1471-0048. 10 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ Sinha, Rajita (1 Ağustos 2013). "The clinical neurobiology of drug craving". Current Opinion in Neurobiology. 23/4 Addiction (İngilizce). 23 (4): 649-654. doi:10.1016/j.conb.2013.05.001. ISSN 0959-4388. PMC 3735834 $2. PMID 23764204.
- ^ a b Volkow, N. D.; Baler, R. D. (1 Ocak 2014). "Addiction science: Uncovering neurobiological complexity". Neuropharmacology. NIDA 40th Anniversary Issue (İngilizce). 76: 235-249. doi:10.1016/j.neuropharm.2013.05.007. ISSN 0028-3908. PMC 3818510 $2. PMID 23688927. 6 Kasım 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ Nestler, Eric J. (28 Aralık 2012). "Transcriptional Mechanisms of Drug Addiction" (İngilizce). 10 (3): 136-143. doi:10.9758/cpn.2012.10.3.136. ISSN 1738-1088. PMC 3569166 $2. PMID 23430970. 7 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Kasım 2022.
- ^ a b c Healy, David (2002). The creation of psychopharmacology. Cambridge, MA: Harvard University Press. ISBN 0-674-00619-4. OCLC 47625320.
- ^ Laurence L. Brunton, Björn C. Knollmann, Randa Hilal-Dandan. Goodman & Gilman's : the Pharmacological Basis of Therapeutics, 13e (İngilizce). McGraw-Hill Education LLC. ss. 55-417. 9 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ a b c "The Dopamine Hypothesis of Schizophrenia: Version III—The Final Common Pathway". Schizophrenia Bulletin. Oxford Academic. doi:10.1093/schbul/sbp006. PMC 2669582 $2. PMID 19325164. 3 Şubat 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ Horacek, Jiri; Bubenikova-Valesova, Vera; Kopecek, Milan; Palenicek, Tomas; Dockery, Colleen; Mohr, Pavel; Höschl, Cyril (1 Mayıs 2006). "Mechanism of Action of Atypical Antipsychotic Drugs and the Neurobiology of Schizophrenia". CNS Drugs (İngilizce). 20 (5): 389-409. doi:10.2165/00023210-200620050-00004. ISSN 1179-1934.
- ^ "The Dopamine Hypothesis of Schizophrenia - Advances in Neurobiology". Psych Scene Hub (İngilizce). 2 Ocak 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ "About antipsychotics". www.mind.org.uk (İngilizce). 16 Temmuz 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ "Major Depression". National Institute of Mental Health (NIMH) (İngilizce). 1 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ a b c Belujon, Pauline; Grace, Anthony A (29 Haziran 2017). "Dopamine System Dysregulation in Major Depressive Disorders". International Journal of Neuropsychopharmacology. 20 (12): 1036-1046. doi:10.1093/ijnp/pyx056. ISSN 1461-1457. PMC 5716179 $2. PMID 29106542. 9 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ Pary, Raymond; Scarff, Jonathan R.; Jijakli, Amal; Tobias, Carmelita; Lippmann, Steven (Nisan 2015). "A Review of Psychostimulants for Adults With Depression". Federal Practitioner. 32 (Suppl 3): 30S-37S. ISSN 1078-4497. PMC 6375494 $2. PMID 30766117. 9 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ekim 2022.
- ^ "catecholamine | chemical compound | Britannica". www.britannica.com (İngilizce). 13 Temmuz 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Ekim 2022.
- ^ "PHENYLETHYLAMINE (PHENETHYLAMINE)". www.chemicalland21.com. 20 Mayıs 2006 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Ekim 2022.