Kimya, maddenin yapısını, özelliklerini, birleşimlerini, etkileşimlerini, tepkimelerini araştıran ve uygulayan bilim dalıdır. Kimya bilmi daha kapsamlı bir ifadeyle maddelerin özellikleriyle, sınıflandırılmasıyla, atomlarla, atom teorisiyle, kimyasal bileşiklerle, kimyasal tepkimelerle, maddenin hâlleriyle, moleküller arası ve moleküler kuvvetlerle, kimyasal bağlarla, tepkime kinetiğiyle, kimyasal dengenin prensipleriyle vb konularla ilgilenir. Kimyanın en önemli dalları arasında analitik kimya, anorganik kimya, organik kimya, fizikokimya ve biyokimya sayılır.

Karbon, doğada yaygın bulunan ametal kimyasal elementtir. Evrende bolluk bakımından altıncı sırada yer alan karbon, kızgın yıldızlarda hidrojenin termonükleer yanmasında temel rol oynar. Dünyada hem doğal halde, hem de başka elementlerle bileşik halinde bulunan karbon, ağırlık olarak Dünya'nın yerkabuğunun yaklaşık %0,2'sini oluşturur. En arı (katışıksız) biçimleri elmas ve grafittir; daha düşük arılık derecelerinde maden kömürünün, kok kömürünün ve odun kömürünün bileşeni olarak bulunur. Atmosferin yaklaşık % 0,05'ini oluşturan ve bütün doğal sularda erimiş olarak bulunan karbon dioksit, kireç taşı ve mermer gibi karbonat mineralleri, kömürün, petrolün ve doğalgazın başlıca yapıtaşları olan hidrokarbonlar, en bol bulunan bileşikleridir.

Alkenler yapılarında en az bir tane karbon-karbon (C=C) çift bağı içeren organik bileşiklerdir. Alkenlerin yapısında karbon-karbon çift bağı bulunduğundan ve bu karbonların yapabileceği en fazla hidrojenle bağ yapmamış olduğundan alkenler doymamış bileşikler kategorisine girerler. Alkenlerin yapısında sadece bir karbon-karbon çift bağının bulunması durumunda homolog seriler oluşturur. Bu homolog serilerin genel formülü CnH2n şeklindedir. Burada n-in en az 2 olma şartı vardır. Aşağıda en basit alken olan eten, yaygın ismiyle etilenin, çeşitli modellemelerle çizilmiş şekillerinin yanı sıra alkenlerin çeşitli şekillerdeki yazılış şekilleri de bulunmaktadır.

Molekül, birbirine bağlı gruplar halindeki atomların oluşturduğu kimyasal bileşiklerin en küçük temel yapısına verilen addır. Diğer bir ifadeyle bir molekül bir bileşiği oluşturan atomların eşit oranlarda bulunduğu en küçük birimdir. Moleküller yapılarında birden fazla atom içerirler. Bir molekül aynı iki atomun bağlanması sonucu ya da farklı sayılarda farklı atomların bağlanması sonucunda oluşabilirler. Bir su molekülü 3 atomdan oluşur; iki hidrojen ve bir oksijen. Bir hidrojen peroksit molekülü iki hidrojen ve 2 oksijen atomundan oluşur. Diğer taraftan bir kan proteini olan gamma globulin 1996 sayıda atomdan oluşmakla birlikte sadece 4 çeşit farklı atom içerir; hidrojen, karbon, oksijen ve nitrojen. Molekülleri oluşturan kimyasal bağlara Moleküler bağlar denir. Bunlar kovalent, iyonik ve metalik bağlardır.

İyonik bağ, zıt yüklü iyonlar arasındaki elektrostatik kuvvetlere dayanan bir kimyasal bağ türüdür.

Kovalent bağ, atomlar arasında elektron çiftleri oluşturmak için elektronların paylaşımını içeren kimyasal bağdır. Bu elektron çiftlerine paylaşılan çiftler veya bağ çiftleri denir. Atomlar arasında elektronları paylaştıklarında çekici ve itici kuvvetlerin kararlı dengesine kovalent bağ denir. Birçok molekül için elektronların paylaşılması her atomun kararlı elektronik gruplaşmasına denk gelen tam değerlik kabuğunun eşdeğerine ulaşmasına olanak tanır.

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.
Kimyasal formül, bir kimyasal birleşiği oluşturan atomlar hakkında detaylı ve açık bilgi veren bir yöntemdir. Moleküler bileşikler için, içindeki elementleri kimyasal sembolleriyle, o elementlerin sayısını da o atomun yanındaki sayılarla belirtirler. Eğer bir molekül, birden çok atom içeriyorsa, bu atomların nicelikleri, yanlarında altyazı olarak belirtilir. İyonik bileşikler ve moleküler olmayan maddeler içinse, atomların girdiği oranlar, bu altyazılarla belirtilir.
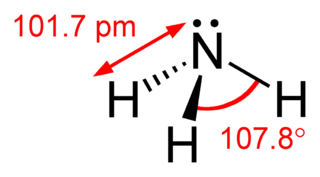
Amonyak, formülü NH3 olan; azot atomu ve hidrojen atomundan oluşan renksiz, keskin ve rahatsız edici kokulu bir bileşiktir. OH- iyonu içermediği hâlde suda zayıf baz özelliği gösterir. Bir amonyak molekülü, bir azot ve üç hidrojen atomundan oluşur. Oda sıcaklığında gaz hâlde bulunan bileşiğin ticari formu sulu çözeltiyi içermektedir.
Değerlik kabuğu elektron çifti itmesi kuralları moleküllerin şekillerini tahmin etmede kullanılır ve değerlik elektron çiftlerinin birbirlerini elektrostatik kuvvetle itmesi temeline dayanır. Teorinin yaratıcısı olan bilim adamlarına atfen Gillespie–Nyholm teorisi olarak da adlandırılır. "VSEPR" kısaltması kimi zaman "vespır" olarak da telaffuz edilebilir.
Teoriye göre atomları çevreleyen değerlik elektron çiftleri birbirlerini iterek aralarındaki itme kuvvetini en aza indirirler ve böylece moleküle şeklini verirler. Merkez atoma bağlı atomların sayısı ile bağ yapmamış elektron çiftlerinin sayısının toplamı sterik numarayı verir.

Yöresizleşmiş elektronlar veya delokalize elektronlar bir katı metal, iyon veya molekülde bulunan elektronların tek bir atom veya kovalent bağ ile ilişkili olmamasını tanımlar.
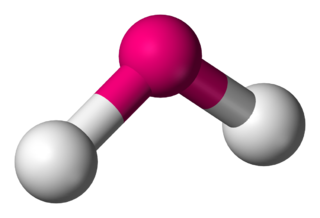
Kimyada, " açısal" ya da "bükülmüş" terimi bazı moleküllere moleküler geometrilerini tanımlamak için kullanılabilir. Oksijen gibi bazı atomlar, Elektron dizilimi nedeniyle hemen hemen her zaman iki (veya daha fazla) kovalent bağını doğrusal olmayan yönlerde ayarlarlar. Su (H2O), analoglarının yanı sıra açısal bir molekül örneğidir. İki hidrojen atomu arasındaki bağ açısı yaklaşık olarak 104,45°'dir. Doğrusal olmayan geometri genel olarak sadece ana grup elementleri içeren diğer üç atomlu molekülleri ve iyonlar için gözlemlenir, belirgin örnekler: Azot dioksit (NO2), kükürt diklorür (SCL2) ve metilen (CH2).

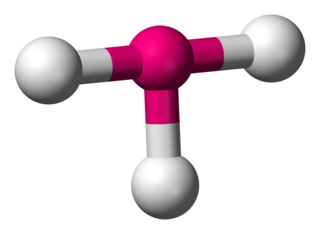
Kimyada, üçgen düzlemsel, merkezde bir atom ve birer üçgenin köşelerinde üç atom olan ve hepsi bir düzlemde çevresel atomlar olarak bulunduğu bir moleküler geometri modelidir. İdeal bir üçgen düzlemsel türde, üç ligand aynıdır ve bütün bağ açıları 120°'dir. Bu türler D3h nokta grubuna aittir. Üç ligandın aynı olmaadığı H2CO gibi moleküller, bu ideal geometri sapma gösterir. Üçgen düzlemsel bir şekle sahip moleküller arasında boron triflorür (BF3), formaldehit (H2CO), fosgen (COCl2) ve kükürt trioksit (SO3) bulunmaktadır. Üçgen düzlem geometrisi olan bazı iyonlar arasında nitrat (NO3-), karbonat (CO3−2) ve guanidinyum (C(NH2)3+)) bulunmaktadır. Organik kimyada, üçgen düzlemsel olarak karbon merkezlerine üç bağlı atomun bulunduğu moleküller çoğunlukla sp2 hibridizasyona sahip olarak tarif edilmiştir.

Kimyada üçgen piramit, apekste bir atomun ve dört yüzlüyü andıran üçgen temelin köşelerinde üç atomun bulunduğu moleküler geometridir (dörtyüzlü moleküler geometri ile karıştırılmamalıdır). Köşelerdeki üç atomun hepsi aynı olduğunda, molekül C3v nokta grubuna aittir. Üçgen piramit geometrisi olan bazı moleküller ve iyonlar; azot grubu hidritler (XH3), ksenon trioksit (XeO3), klorat iyonu ClO3- ve sülfit iyonu SO3−2. Organik kimyada, üçgen piramit geometriye sahip moleküller bazen sp3 hibridize olarak açıklanmaktadır. AXE yöntemi için Vsepr teori sınıflandırması AX3E1'dir.
Kimyada, T-şeklindeki moleküler geometri, merkezi bir atomun üç liganda sahip olduğu bazı moleküllerin yapılarını açıklar. Normalde, üç koordineli bileşikler üçgen düzlemsel veya piramidal geometrileri kullanır. T-şekilli moleküllerin örnekleri arasında, halojen triflorürler vardır, örneğin ClF3.
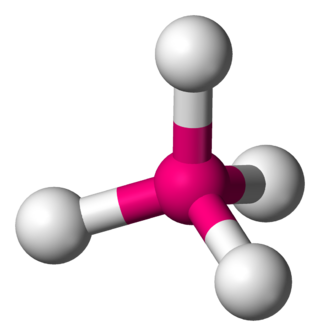
Dörtyüzlü veya tetrahedral molekül geometrisi, merkezi atomun, dört yüzlünün ortasında, dört köşede ise sübstitüentlerin yer aldığı molekül geometrisidir. Bağ açıları, dört sübstitüent aynı olduğunda (örn. metan CH4 ya da daha ağır analogları) cos−1 (-⅓) = 109,4712206 ...° ≈ 109.5° olur. Metan veya diğer simetrik yüzlü moleküller Td nokta grubuna aittir, ama dörtyüzlü moleküller genellikle düşük simetriye sahiptir. Tetrahedral moleküller kiral olabilir.

Kimyada, çift kepli üçgen prizmatik moleküler geometri, sekiz atom, atom grupları veya ligand gruplarının, çift-taraflı bir üçgen prizmanın köşelerini tanımlayan merkezi bir atomun etrafına yerleştirildiği bileşiklerin şeklini açıklar. Bu şekil, C2v olan simetri ile birlikte, okta-koordine geçiş metali kompleksleri için kare antiprizma ve onikiyüzlü ile birlikte üç genel biçimlerinden bir tanesidir.

Kimyada, onikiyüzlü moleküler geometri, sekiz atomun, atom gruplarının veya ligandların bir snub disfenojeninin köşelerini tanımlayan merkezi bir atomun etrafına yerleştirildiği bileşiklerin şeklini tarif eder. Bu şekil D2d simetriye sahiptir ve kare antiprizma ve çift kepli üçgen prizma ile birlikte oktakoordinat geçiş metali kompleksleri için üç ortak şekilden biridir.

Kimyada, oktahedral moleküler geometri, bir oktahedronun köşelerini tanımlayan, merkezi bir atom etrafında simetrik olarak düzenlenmiş altı atomlu bileşiklerin veya atom gruplarının veya ligandların şeklini tanımlar. Oktahedronun sekiz yüzü vardır, dolayısıyla octa ön ekini alır. Oktahedron, Platonik katılardan biridir, ancak oktahedral moleküller tipik olarak merkezlerinde bir atom içerir ve ligand atomları arasında bağ yoktur. Mükemmel bir oktahedron Oh nokta grubuna aittir. Oktahedral bileşiklerin örnekleri arasında kükürt hekzaflorür SF6 ve molibden hekzakarbonil Mo (CO)6 gösterilebilir. "Oktahedral" terimi, kimyagerler tarafından, merkezi atoma olan bağların geometrisine odaklanarak ve ligandların kendi aralarındaki farklılıkları dikkate almadan biraz gevşek bir şekilde kullanılır. Örneğin, N-H bağlarının oryantasyonu nedeniyle matematiksel anlamda oktahedral olmayan [Co(NH3)6]3+, oktahedral olarak adlandırılır.
Karbon-karbon bağı, iki karbon atomu arasındaki kovalent bir bağdır. En yaygın şekli tekli bağdır: iki atomun her birinden birer tane olmak üzere iki elektrondan oluşan bir bağ. Karbon-karbon tekli bağı bir sigma bağıdır ve karbon atomlarının her birinden bir hibridize orbital arasında oluşur. Etanda orbitaller sp3-hibridize orbitallerdir, ancak diğer hibridizasyonlara sahip karbon atomları arasında oluşan tek bağlar meydana gelir. Aslında, tekli bağdaki karbon atomlarının aynı hibridizasyona sahip olması gerekmez. Karbon atomları ayrıca alken adı verilen bileşiklerde çift bağ veya alkin adı verilen bileşiklerde üçlü bağ oluşturabilir. Bir çift bağ, sp2-hibritleşmiş bir orbital ve hibritleşmeye dahil olmayan bir p-orbitali ile oluşturulur. Üçlü bağ, sp-hibritleşmiş bir orbital ve her atomdan iki p-orbitali ile oluşturulur. P-orbitallerinin kullanımı bir pi bağı oluşturur.

















