Ametal, metal özelliği göstermeyen elementlerdir. Isıyı ve elektrik akımını iletmek gibi metallere özgü özellikleri göstermezler. Ayrıca kendi aralarındaki ortak özellikleri yok denecek kadar azdır. Genellikle karbon, azot, fosfor, oksijen, kükürt, selenyum, flor, klor, brom, iyot ve soy gaz elementlerine ametal denir.

Amino asitler, proteinleri oluşturan temel yapı taşlarıdır.

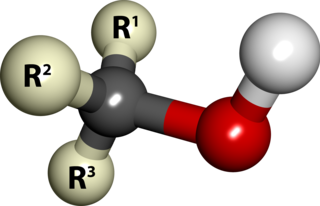
Aldehitler, yapılarında karbonil grubuna bağlı bir hidrojenin olduğu organik bileşiklerdir. Düşük karbonlu aldehitler polar moleküller olup düşük ve yoğun fazlarda hidrojen bağı içermezler. Aynı karbon sayılı ketonlara göre kaynama noktası aldehitlerde daha yüksektir.
Alkol, karbon atomuna doğrudan bir -OH (hidroksil) grubunun bağlı olduğu organik bileşiklere verilen genel ad. Genel formülü CnH2n+1OH olan mono alkoller, alkollerin önemli bir sınıfıdır. Bunlardan etanol (C2H5OH), alkollü içeceklerde bulunan türüdür. Genellikle alkol kelimesi ile etanol kastedilir ki yeni fermente olmuş birada etanol oranı %3-5 arasında iken şarapta %12-15 arasındadır.

Tuz, kimyada, bir asitle bir bazın tepkimeye girmesi neticesinde meydana gelen maddedir. Tuz, asitteki eksi yüklü iyonla (anyon) bazdaki artı yüklü iyondan (katyon) meydana gelir. Asitle baz arasındaki nötralleşme tepkimesi esnasında tuz ve su açığa çıkar. Erimiş tuz veya çözelti halindeki tuzların çoğu eksi ile artı yüklü iyonlarına ayrışır ve elektriği iletir. Tuz adı ayrıca sofra tuzu veya sodyum klorür (NaCl) için de kullanılır.
Hidroliz işlemi suyu oluşturan hidrojen ve oksijen elementlerinin birbirinden ayrılması ile sonuçlanan bir işlemdir. Bazı kaynaklarda hidroliz, moleküllerin su ilavesiyle daha fazla sayıda parçacık oluşturması olarak da geçer. Hidroliz, su ile bir kimyasal bağın parçalanmasıdır yani bir kimyasal reaksiyondur. Hidroliz genel olarak suyun nükleofil olduğu ikame(yer değiştirme reaksiyonu), eliminasyon(organik reaksiyon türü) ve solvasyon (çözme) reaksiyonları için kullanılır.

İyon ya da yerdeş, bir veya daha çok elektron kazanmış ya da yitirmiş bir atomdan oluşmuş elektrik yüklü parçacıktır. Atomlar kararsız yapılarından kurtulmak ve kararlı hale gelebilmek için elektron alırlar ya da kaybederler. Bunun için de başka bir atomla ya da kökle bağ kurarlar.

İyonik bağ, zıt yüklü iyonlar arasındaki elektrostatik kuvvetlere dayanan bir kimyasal bağ türüdür.
İyonlaşma enerjisi ya da iyonizasyon enerjisi, gaz halindeki bir atomun son temel enerji seviyesindeki çekirdek tarafından en az kuvvetle çekilen bir elektronu koparmak için verilmesi gereken en az enerji miktarıdır. Elementlerin elektron alış verişi sonucu oluşturdukları katyon ve anyonların oluşturduğu tepkimelerdir.Asitlerin iyonlaşması demek, kendini oluşturan (+) ve (-) yüklü iyonlarına ayrışması demektir.Asitler, saf haldeyken elektrik akımını iletemeyip sadece suda çözündüklerinde elektrik akımını iletebilirler. Mesela;

Karboksilik asitler karboksil grubu olan organik asitlerdir, -C(=O)OH formülüne sahiptirler, bu genelde -COOH veya CO2H olarak da yazılır. Karboksilik asitler Bronsted asitleridir, yani proton vericileridir. Karboksilik asitlerin tuz ve anyonlarına karboksilat denir. Karboksilik asitler, esterlerle fonsiyonel grup izomeridirler. Karboksilik asitlerin en basit dizisi alkanoik asitlerdir, R-COOH formülüyle gösterilirler, R bir hidrojen atomu veya bir alkil grubuna karşılık gelir. Bileşiklerde birden fazla karboksilik asit grubu bulunabilir.
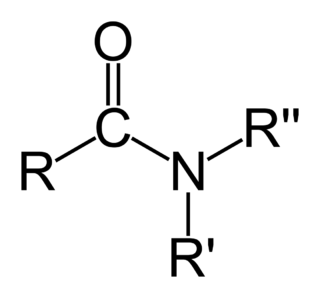
Kimyada amid sözcüğü iki anlama sahiptir: - Birinci anlamıyla amid, bir azot atomuna (N) bağlı bir karbonil grubu bulunduran bir organik fonksiyonel grup veya bu gruba sahip bir bileşiktir. - İkinci anlamıyla amid, bir azot anyonudur.

Aminler, amonyaktaki bir veya daha fazla hidrojen atomunun organik radikaller ile değiştirilmesi yöntemiyle türetilmiş organik bileşikler ve fonksiyonel gruplardır. Yapısal olarak aminler amonyağa benzerler, ama bir veya daha fazla hidrojen atomu, alkil veya aril gibi organik sübstitüentlerle yer değiştirmiştir. Bu kuralın önemli bir istisnası RC(O)NR2 tipi bileşiklerdir (C(O) karbonil grubuna karşılık gelir), bunlara amin yerine amid denir. Amidler ve aminlerin yapıları ve özellikleri farklı olduğu için bu ayrım kimyasal olarak önemlidir. Adlandırma açısında biraz akıl karıştırıcı olan bir nokta, bir aminin N-H grubunun N-M (M= metal) ile değişmesi hâlinde buna da amid denmesidir. Örneğin (CH3)2NLi, lityum dimetilamid'dir.

Sülfat iyonu, inorganik kimyada bir sülfür atomu ile bunu tetrahedral yapıda çevreleyen dört eş oksijen atomundan oluşan, negatif yüklü bir anyondur. Ampirik formülü SO42- ve moleküler ağırlığı 96,06 daltondur. Hidrojenle birleştiğinde sülfürik asit oluşturur. Ayrıca,Dimetil sülfat gibi organik sülfatlar, kovalent bileşiklerdir ve sülfürik asidin esterleridir.
- Sülfürik asitte metalin eritilmesi
- Sülfürik asidin bir metal hidroksit veya oksit ile reaksiyonu
- Metal sülfür veya sülfitlerin oksidasyonu
Eritroz, C4H8O4 formülüne sahip bir tetrozdur. Bu bileşiğin her molekülünde bir aldehit grubu bulunmaktadır. Bu nedenle eritroz bir aldozdur. Maddenin doğal izomerinin adı D-eritroz'dur.

Akridin, C13H9N, heterosiklik bir organik bileşiktir. Akridin terimi ayrıca C13N üçlü halkasını içeren bileşiklere değinmek için kullanılır.
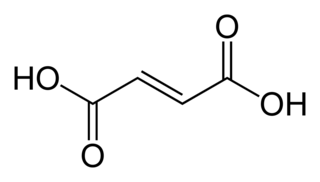
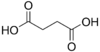
Fumarik asit ya da trans-bütendioik asit, kimyasal formülü  olan kimyasal bir bileşiktir. Bu beyaz kristalli bileşik iki adet izomerik doymamış dikarboksilik asitten birisidir, diğeri maleik asittir. Fumarik asitte, karboksilik asit grupları trans (E) formunda iken maleik asitte cis (Z) formundadır. Fumarik asit meyve tadı veren bir aromaya sahiptir. Tuzları ve esterleri fumaratlar olarak bilinir. Dimetil fumaratın multipl skleroz hastalığında özürlülük ilerlemesini anlamlı olarak azalttığı bulunmuştur.
olan kimyasal bir bileşiktir. Bu beyaz kristalli bileşik iki adet izomerik doymamış dikarboksilik asitten birisidir, diğeri maleik asittir. Fumarik asitte, karboksilik asit grupları trans (E) formunda iken maleik asitte cis (Z) formundadır. Fumarik asit meyve tadı veren bir aromaya sahiptir. Tuzları ve esterleri fumaratlar olarak bilinir. Dimetil fumaratın multipl skleroz hastalığında özürlülük ilerlemesini anlamlı olarak azalttığı bulunmuştur.
Organik reaksiyonlar, organik maddelerin tepkimelerine verilen genel addır.
Kimya ve biyokimyada ayrışma, moleküllerin (veya tuzlar veya bileşikler gibi iyonik bileşiklerin) atomlar, iyonlar veya radikaller gibi daha küçük parçacıklara ayrıldığı genel bir süreçtir. Örneğin, bir asit suda çözündüğünde, bir elektronegatif atom ile bir hidrojen atomu arasındaki kovalent bir bağ, bir proton (H+) ve bir negatif iyon veren heterolitik fisyon tarafından kırılır. Ayrışma, birleşme veya rekombinasyonun tersidir.
Karboksilik asitlerden 3C'a sahip olan propiyonik asit içerdiği hidrojen bağları ile güçlü olup kaynama noktası diğer fonksiyonel gruplardan (sırasıyla) Alkol-Keton-Aldehit-Eter büyüktür. Propionik asit CH3CH2CO2H kimyasal formülüne sahip doğal olarak oluşan bir karboksilik asittir. Vücut kokusuna benzeyen keskin ve hoş olmayan bir kokuya sahip bir sıvıdır. CH3CH2CO2− anyonu ile propiyonik asidin tuzları ve esterleri, propiyonatlar veya propanoatlar olarak bilinir.

İyonik bileşik; iyonların, iyonik bağların oluşturduğu elektrostatik kuvvetlerle bir arada tutulmalarıyla oluşan bir bileşik türüdür. Bu tür bileşikler, katyon olarak adlandırılan pozitif yüklü parçacıklar ile anyon olarak adlandırılan negatif yüklü iyonlardan oluşmakla birlikte genel anlamda yüksüzdürler.