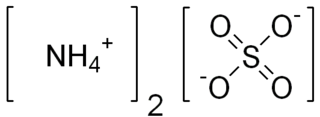Diamonyum fosfat
 | |
| Adlandırmalar | |
|---|---|
diamonyum hidrojen fosfat | |
Diğer adlar amonyum monohidrojen fosfat, amonyum hidrojen fosfat, amonyum fosfat dibazik | |
| Tanımlayıcılar | |
CAS numarası | |
3D model (JSmol) | |
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.029.079 |
| E numaraları | E342(ii) (antioksidanlar, ...) |
PubChem CID | |
| UNII | |
CompTox Bilgi Panosu (EPA) | |
| |
| |
| Özellikler | |
| Molekül formülü | (NH4)2HPO4 |
| Molekül kütlesi | 132.06 g/mol |
| Görünüm | renksiz monoklinik kristaller |
| Yoğunluk | 1.619 g/cm3 |
| Erime noktası | 155 °C bozunur |
| Çözünürlük (su içinde) | 57.5 g/100 mL (10 °C) 106.7 g/100 mL (70 °C) |
| Çözünürlük | alkol, aseton ve sıvı amonyakda çözünmez |
| Kırınım dizimi (nD) | 1.52 |
| Termokimya | |
Standart formasyon entalpisi (ΔfH⦵298) | −1566.91 kJ/mol |
| Tehlikeler | |
| NFPA 704 (yangın karosu) | |
| Parlama noktası | Yanıcı değildir |
| Güvenlik bilgi formu (SDS) | ICSC 0217 |
| Benzeyen bileşikler | |
Diğer anyonlar | Monoamonyum fosfat Amonyum fosfat |
Diğer katyonlar | Disodyum fosfat Dipotasyum fosfat |
Benzeyen bileşikler | Amonyum nitrat Amonyum sülfat |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |
Diamonyum fosfat (DAP; IUPAC adı diamonyum hidrojen fosfat; kimyasal formülü (NH4)2(HPO4) olan amonyak]] ve fosforik asitin reaksiyonu ile üretilebilen bir dizi suda çözünür amonyum fosfat tuzlarından biridir.
Katı diamonyum fosfat, aşağıdaki ifade ve denklemle verilen amonyağın ayrışma basıncını gösterir:[2](NH
4)
2HPO
4(s) ⇌ NH
3(g) + (NH
4)H
2PO
4(s)
100 °C'de, diamonyum fosfatın ayrışma basıncı yaklaşık 5 mmHg'dir.[3]
CF Industries, Inc.'in diamonyum fosfat MSDS'sine göre ayrışma 70 °C kadar düşük bir sıcaklıkta başlar: "Tehlikeli Bozunma Ürünleri: Oda sıcaklığında havaya maruz kaldığında kademeli olarak amonyağı kaybeder. Yaklaşık 70 °C'de amonyak ve monoamonyum fosfata ayrışır. 155 °C’de, DAP fosfor oksitler, azot oksitler ve amonyak gazı ortaya çıkarır."
Kullanımı
DAP gübre olarak kullanılır.[4] Bitki besin maddesi olarak uygulandığında, toprak pH'ını geçici olarak yükseltir, ancak uzun vadede, amonyumun nitrifikasyonu nedeniyle işlenmiş zemin eskisinden daha asidik hale gelir. Amonyum iyonunun yüksek pH'lı bir ortamda amonyağa dönüşme olasılığı daha yüksek olduğundan dolayı alkali kimyasal maddelerle kullanımı uygun değildir. Çözeltideki ortalama pH 7,5–8'dir.[5] Tipik formülasyon 18-46-0 dır. (%18 N, %46 P2O5, %0 K2O).[5]
DAP yangın geciktirici olarak kullanılabilir. Malzemenin yanma sıcaklığını düşürür, maksimum ağırlık kaybı oranlarını düşürür ve artık veya kömür üretiminde artışa neden olur.[6] Bunlar, piroliz sıcaklığını düşürmek ve oluşan kömür miktarını artırmak, mevcut yakıt miktarını azalttığından ve bir yangın önleme şeridi oluşumuna yol açabileceğinden, orman yangınlarıyla mücadelede önemli etkilerdir. Bazı popüler ticari yangınla mücadele ürünlerinin en büyük bileşeni ve "yangın geciktirici" sigaraların içeriğidir.[7]
DAP ayrıca şarap ve bal şarabı yapımında maya besini olarak; bazı sigara markalarında nikotin arttırıcı olduğu iddia edilenen bir katkı maddesi olarak; kibritlerde kor ateşini önlemek için, şekerin arıtılmasında; kalay, bakır, çinko ve pirinç lehimlemek için bir lehim pastası olarak ve alkalide çözünen ve asitte çözünmeyen kolloidal boyaların yün üzerinde çökelmesini kontrol etmek için de kullanılır.[1]
Doğal oluşumu
Bileşik, doğada son derece nadir mineral fosfamit olarak bulunur.[8][9] Benzer dihidrojen bileşiği, mineral bifosfamit olarak oluşur.[9][10] Her ikisi de guano yataklarıyla bağlantılıdır.[8][10]
Kaynakça
- ^ a b Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, 0-07-049439-8
- ^ John R Van Wazer (1958). Phosphorus And Its Compounds - Volume I: Chemistry. New York: Interscience Publishers, Inc. s. 503.
- ^ McKetta Jr, John J., (Ed.) (1990). Encyclopedia of Chemical Processing and Design (Chemical Processing and Design Encyclopedia). New York: Marcel Dekker, Inc. s. 478. ISBN 0-8247-2485-2.
- ^ IPNI. "Diammonium Phosphate" (PDF). www.ipni.net. International Plant Nutrition Institute. 24 Eylül 2015 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 21 Haziran 2014.
- ^ a b International Plant Nutrition Institute. "Nutrient Source Specifics: Diammonium Phosphate" (PDF). 21 Ekim 2012 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 10 Aralık 2012.
- ^ George, C.W.; Susott, R.A. (Nisan 1971). "Effects of Ammonium Phosphate and Sulfate on the Pyrolysis and Combustion of Cellulose". Research Paper INT-90. Intermountain Forest and Range Experiment Station: USDA Forest Service. 22 Eylül 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Aralık 2022.
- ^ Phos-Chek MSDS[]Şablon:Ölülink, Phos-Chek website
- ^ a b "Phosphammite". www.mindat.org. 7 Ocak 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Kasım 2020.
- ^ a b "List of Minerals". www.ima-mineralogy.org. 21 Mart 2011. 15 Mart 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Kasım 2020.
- ^ a b "Biphosphammite". www.mindat.org. 7 Ocak 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Kasım 2020.
Dış bağlantılar
- International Chemical Safety Card 0217 26 Aralık 2022 tarihinde Wayback Machine sitesinde arşivlendi.
- Diammonium phosphate fertilizer manufacturing process flowsheet 3 Ocak 2019 tarihinde Wayback Machine sitesinde arşivlendi.