
Elektron dizilimi, atom fiziği ve kuantum kimyasında, bir atom ya da molekülün elektronlarının atomik ya da moleküler orbitallerdeki dağılımıdır. Örneğin Neon atomunun elektron dizilimi 1s2 2s2 2p6 olarak gösterilir.
Elektronegatiflik, kimyada bağ yapımında kullanılan elektronların bağı oluşturan atomlar tarafından çekilme gücüdür. Klor gibi dış enerji seviyeleri hemen hemen tamamen doldurulmuş atomlar güçlü elektronegatiftirler ve kolaylıkla elektron alırlar. Buna karşın sodyum gibi dış seviyeleri hemen hemen boş olan atomlar kolaylıkla elektronlarını verirler ve güçlü elektropozitiftirler. Elektronegatifler ile elektron ilgileri karıştırılmamalıdır.

Molekül, birbirine bağlı gruplar halindeki atomların oluşturduğu kimyasal bileşiklerin en küçük temel yapısına verilen addır. Diğer bir ifadeyle bir molekül bir bileşiği oluşturan atomların eşit oranlarda bulunduğu en küçük birimdir. Moleküller yapılarında birden fazla atom içerirler. Bir molekül aynı iki atomun bağlanması sonucu ya da farklı sayılarda farklı atomların bağlanması sonucunda oluşabilirler. Bir su molekülü 3 atomdan oluşur; iki hidrojen ve bir oksijen. Bir hidrojen peroksit molekülü iki hidrojen ve 2 oksijen atomundan oluşur. Diğer taraftan bir kan proteini olan gamma globulin 1996 sayıda atomdan oluşmakla birlikte sadece 4 çeşit farklı atom içerir; hidrojen, karbon, oksijen ve nitrojen. Molekülleri oluşturan kimyasal bağlara Moleküler bağlar denir. Bunlar kovalent, iyonik ve metalik bağlardır.

İyonik bağ, zıt yüklü iyonlar arasındaki elektrostatik kuvvetlere dayanan bir kimyasal bağ türüdür.

Kovalent bağ, atomlar arasında elektron çiftleri oluşturmak için elektronların paylaşımını içeren kimyasal bağdır. Bu elektron çiftlerine paylaşılan çiftler veya bağ çiftleri denir. Atomlar arasında elektronları paylaştıklarında çekici ve itici kuvvetlerin kararlı dengesine kovalent bağ denir. Birçok molekül için elektronların paylaşılması her atomun kararlı elektronik gruplaşmasına denk gelen tam değerlik kabuğunun eşdeğerine ulaşmasına olanak tanır.

Metalik bağ, esas olarak metaller arasındaki, bir ya da daha çok atomu bir arada tutan bir kimyasal bağ türüdür. Metal atomlarının latisindeki serbest elektronların yer değiştirmiş olarak paylaşılması esasına dayanır. Metalik bağ, kovalent bağ ve iyonik bağ ile birlikte üç güçlü etkileşimden (bağ) biridir. Kimyasal bir etkileşimdir.

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.

Atom yarıçapı, küre şeklinde olduğu düşünülen atomların büyüklüklerini ölçmekte kullanılan bir niceliktir. Bu nicelik bir atomun çekirdeği ile elektron bulutu arasındaki uzaklığı ifade eder.
Koordine kovalent bağ, ametal-ligand arasındaki bağın, sadece ligand üzerindeki elektronlar ile oluşması durumunda oluşan kovalent bağ türü. Elektron ortaklaşması göstermemektedir.
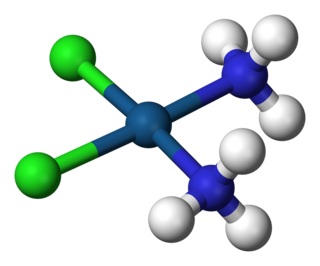
Kompleks, merkez atom olarak bir ya da birden fazla metal atomu veya iyonu ve metale bağlı ligandlardan oluşan yapıdır. Ligand, metale elektron vererek kompleks oluşturur. Metal içeren bileşiklerin birçoğu, özellikle geçiş metalleri içerenler koordinasyon bileşikleridir.
Ligand aşağıdaki anlamları taşıyabilir:
- Ligand (kimya), koordine kovalent bağ aracılığıyla bir veya daha çok elektronunu bir veya daha çok merkez atom veya iyona veren, atom, iyon veya fonksiyonel grup.
- Ligand (biyokimya), reseptörlere bağlanan hücre dışında bir bileşik.
Ligand ya da ligant, merkezî bir metale bağlanan bir atom, iyon veya moleküldür. Bu bağ genelde bir veya birkaç elektron verilmesiyle oluşur, kovalent de olabilir iyonik de. Ayrıca, metal-ligand bağ değeri birden üçe kadar uzanabilir. Ligandlar genelde Lewis bazı(en) olarak sayılırlar ama ender olarak Lewis asidi ligandlar da olabilir.

Şelasyon iki veya çok dişli bir kimyasal ligandın iyonik bir substrata bağlanması veya komplekslenmesidir. Bu ligandlar ki genelde organik bileşiklerdir, şelatör veya şelat ajanı olarak adlandırılır. Şelatörler, ASTM-A-380 standardına göre, "belli metal iyonları ile suda çözünür kompleksler oluşturan kimyasallardır, bu sayede iyonu etkinsizleştirerek onun başka elementler veya iyonlarla tepkitmeyerek, çökelek veya tortu oluşmamasını sağlar". Ligand, substrat ile birleşip bir şelat kompleksi meydana getirir. Bu terim, metal iyonunu şelatördeki iki veya daha çok atomla bağlandığı kompleksler için kullanılır. Literatürde metal iyonu tutan bağların sayısına değinmek için dişlilik terimi kullanılır, örneğin yandaki resimde görülen EDTA altı dişli bir şelatördür.

Organik kimyada bazı atom halkalarının yapısı beklenenin üstünde kararlıdır. Doymamış bağlar, yalın elektron çiftleri veya boş orbitallerden oluşan konjüge bir halkanın konjüge olmasından beklenecek kararlılıktan daha yüksek bir kararlılık gösterme özelliğine aromatiklik denir. Aromatiklik, halkasal delokalizasyon ve rezonansın bir belirtisi olarak da düşünülebilir.
Kuantum mekaniğine göre atomik orbital, elektronların atom çekirdeği etrafındaki konumunu ve dalga-benzeri özelliklerini tanımlayan bir matematiksel fonksiyondur. Elektronun atom çekirdeği etrafındaki belirli bir bölgede bulunma olasılığı bu fonksiyon aracılığı ile hesaplanabilir. Fizikte atomik, kimyada orbital olarak geçer.
Değerlik kabuğu elektron çifti itmesi kuralları moleküllerin şekillerini tahmin etmede kullanılır ve değerlik elektron çiftlerinin birbirlerini elektrostatik kuvvetle itmesi temeline dayanır. Teorinin yaratıcısı olan bilim adamlarına atfen Gillespie–Nyholm teorisi olarak da adlandırılır. "VSEPR" kısaltması kimi zaman "vespır" olarak da telaffuz edilebilir.
Teoriye göre atomları çevreleyen değerlik elektron çiftleri birbirlerini iterek aralarındaki itme kuvvetini en aza indirirler ve böylece moleküle şeklini verirler. Merkez atoma bağlı atomların sayısı ile bağ yapmamış elektron çiftlerinin sayısının toplamı sterik numarayı verir.
Organik reaksiyonlar, organik maddelerin tepkimelerine verilen genel addır.

Yöresizleşmiş elektronlar veya delokalize elektronlar bir katı metal, iyon veya molekülde bulunan elektronların tek bir atom veya kovalent bağ ile ilişkili olmamasını tanımlar.

Kimyada, oktahedral moleküler geometri, bir oktahedronun köşelerini tanımlayan, merkezi bir atom etrafında simetrik olarak düzenlenmiş altı atomlu bileşiklerin veya atom gruplarının veya ligandların şeklini tanımlar. Oktahedronun sekiz yüzü vardır, dolayısıyla octa ön ekini alır. Oktahedron, Platonik katılardan biridir, ancak oktahedral moleküller tipik olarak merkezlerinde bir atom içerir ve ligand atomları arasında bağ yoktur. Mükemmel bir oktahedron Oh nokta grubuna aittir. Oktahedral bileşiklerin örnekleri arasında kükürt hekzaflorür SF6 ve molibden hekzakarbonil Mo (CO)6 gösterilebilir. "Oktahedral" terimi, kimyagerler tarafından, merkezi atoma olan bağların geometrisine odaklanarak ve ligandların kendi aralarındaki farklılıkları dikkate almadan biraz gevşek bir şekilde kullanılır. Örneğin, N-H bağlarının oryantasyonu nedeniyle matematiksel anlamda oktahedral olmayan [Co(NH3)6]3+, oktahedral olarak adlandırılır.
Koordinasyon geometrisi, merkezî atom etrafındaki atomlar tarafından tanımlanan geometrik modeldir. Terim, çeşitli yapıların gözlendiği inorganik kimya alanında yaygın olarak kullanılır. Koordinasyon geometrisi, metal merkezine bağlı ligandların türüne değil sayısına ve konumlarına bağlıdır. Bağlanan atomların sayısı koordinasyon numarasıdır. Geometrik desen, çokyüzlünün köşelerinin ligandlardaki koordine eden atomların merkezleri olduğu bir çokyüzlü olarak tanımlanabilir.











