David E. Clemmer
David E. Clemmer | |
|---|---|
 | |
| Doğum | 23 Şubat 1965 Alamosa, Amerika Birleşik Devletleri |
| Milliyet | Amerikalı |
| Eğitim | Adams Eyalet Koleji Utah Üniversitesi |
| Tanınma nedeni | İyon hareketliliği spektrometrisi, kütle spektrometrisi |
| Ödüller | Biemann Madalyası, ACS Kimyasal Enstrümantasyon Ödülü |
| Resmî site | indiana.edu/~clemmer/home.htm |
| Kariyeri | |
| Dalı | Analitik kimya, Kütle spektrometrisi |
| Çalıştığı kurumlar | Indiana Üniversitesi |
| Doktora danışmanı | Peter B. Armentrout |
David E. Clemmer (d. 23 Şubat 1965, Alamosa), Amerikalı analitik kimyager. Bloomington'daki Indiana Üniversitesi'nde Robert ve Marjorie Mann Kimya Kürsüsü başkanı ve Seçkin Profesör'dür. Bu üniversitede Clemmer Grubu'nun başındadır.[1] Clemmer iyon-hareketliliği kütle spektrometrisi (IM-MS) için yeni bilimsel ekipmanlar geliştirir. Geliştirdiği ekipmanlar arasında ilk iç içe iyon-hareketliliği uçuş-zamanlı kütle spektroskmetrisi de vardır.[2] Aralarında 2006'da "çeşitli kütle spektrometre teknolojileri için iyon hareketliliği ayırmanın entegrasyonuna yaptığı öncü katkıları için" kazandığı Biemann Madalyası'nın da bulunduğu çeşitli ödüller kazanmıştır.
Gençliği ve eğitimi
Clemmer 23 Şubat 1965'te sanatçı Ed Clemmer ve öğretmen eşi Mary Ann'in oğlu olarak Alamosa, Colorado'da dünyaya geldi.[3] Adams Eyalet Koleji'ne gitti. Burada önce müzik eğitimi almaya başladı ancak daha sonra bilime döndü. 1987'de kimya alanında lisans derecesini şeref ile tamamladı. Ardından Utah Üniversitesi'ne gitti. Burada fiziksel kimya alanındaki doktorasını 1992'de tamamladı.[4] Tez danışmanı Peter B. Armentrout[2] ile gaz reaksiyonlarında dönüşüm metal iyonları üstüne çalıştı.[5]
Kariyeri
1992-1993 arasında Clemmer doktora sonrası çalışmaları için Japonya'ya gitti. Buradaki çalışmaları için Himeji Teknoloji Enstitüsü'ndeki Japon Bilimsel İşbirliğini Destekleme Topluluğu'ndan destek aldı. Kenji Honma ile elektron transferi mekanizmaları[6] ve uyarılmış haldeki metal atomları ve gaz molekülleri reaksiyonları üstüne çalıştı.[5] 1993-1995 arasında Clemmer Northwestern Üniversitesi'nde Martin F. Jarrold ile doktora sonrası araştırma görevlisi olarak çalıştı.[5] Burada iyon-hareketliliği spektrometrisi gibi yöntemleri kullanarak protein katlanması ve gaz fazında protein yapısı üstüne çalıştı.[7][8]
1995'te Clemmer Indiana Üniversitesi Kimya Bölümü'ne girdi.[5] 2002-2006 yılları arasında Kimya Bölüm Başkanı olarak çalıştı.[9] Bu üniversitede profesör olarak çalışmaktadır ve 2002'de adını kendi verdiği Robert ve Marjorie Mann Kimya Kürsüsü'nde faaliyet göstermektedir.[4][5] 230'dan fazla makale yayımlamıştır.[1]
Etkilendikleri arasında Michael T. Bowers, Jesse L. Beauchamp, R. Graham Cooks, Scott A. McLuckey, Fred Mclafferty, Even R. Williams, Joseph A. Loo, Vicki Wysocki ve Julie A. Leary vardır.[2] Doktora öğrencileri arasında Renã A. S. Robinson, Stephen Valentine, Cherokee Hoaglund-Hyzer[10] ve Catherine Srebalus Barnes vardır.[11]
Araştırma
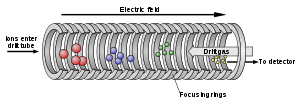
Clemmer özellikle karmaşık düşük simetrik sistemlerin biçimsel dinamikleri ve yapısal karakterizasyonu ile ilgilenmiştir. İyon-hareketliliği spektrometrisi ile gaz fazında biyomoleküler yapı ve kompleks biyomoleküler karışımların incelenmesi için bilimsel ekipman ve yöntemler geliştirir.[11]
İyon hareketliliği yönteminde iyonlar elektrik yüklü tampon gazdan geçme yeteneğine göre farklı gruplara ayrılır. Bu sayede kompleks karışımların sadece kütle spektrometrisiyle ayrılabileceğinden daha fazla ayrıştırılıması sağlanır. Çok küçük bileşik miktarları bile ayrıştırılabilir ve büyüklük, şekil, yük ve kütle gibi karakteristik özelliklerine göre ayrı ayrı incelenebilir.[2]
Clemmer yaptığı "kapsamlı çalışmalar" ve bulduğu "devrimsel ekipman yöntemleri" ile iyon hareketliliğinin hem güçlü bir yöntem hem bir araştırma alanı olmasına katkı sağlamıştır.[5] Clemmer ve Jarrold ilk çalışmalarında iyon-hareketliliği spektrometrisinin çözünürlük gücünü artırmak için uzun sürüklenme tüplerinde yığılmayan gaz atmosferler kullandı.[12] Clemmer'in iyon hareketliliği-kütle spektrometrisi (IM-MS) için gaz fazı ayrıştırma yöntemleri ve bunun bozulmamış proteinlerin yapısal analizde kullanılması biyomoleküler yapıların incelenmesinde IM-MS kullanımı için "özellikle önemli bir mihenk taşı" olarak değerlendirilir.[13][14][15] Clemmer ve meslektaşları hareketli iyon ile kütle spektroskopisi ekipmanlarını bir araya getiren en az bir düzine farklı modüler parça konfigürasyonları geliştirmiştir.[2][16] Bunlara iyon hareketliliğini uçuş zamanlı kütle spektrometrisi (TOF) ile birleştirilmesi de dahildir.[17][18][19] Aynı zamanda ilk iç içe iyon-hareketliliği uçuş-zamanlı kütle spektrometrisini de geliştirdiler.[2][5]
Böyle ekipmanlar araştırmacıların dinamik sistemlerin hem yapıları hem de biçimleri üstünde daha fazla bilgi sahibi olmasını sağlar.[20] Clemmer yüklü haller ve yapılar arasındaki temel ilişkileri belirledi ve gaz hallerinin birden fazla biçiminde tek bir yük hali olabileceğini gösterdi.[3] Böyle teknikler hem proteinlerin hem peptitlerin incelenmesinde kullanılabilir.[3][21] Erken dönem çalışmalarında Clemmer hemeprotein sitokrom c'nin farklı biçimlerinin hareketliliğe göre ayırt edilebileceğini gösterdi.[22] Buna ek olarak farklı kiral izomerlerin hareketliliği protein katlanmalarıyla ilişkilidir.[23] Daha yakın zamanda geliştirilen teknikler araştırmacıların gaz fazı sırasında makromoleküler iyonların biçimlerindeki değişimleri takip etmelerini sağlamıştır. Elektrosprey iyonizasyon ile sürüklenme tüpünde kısa bir iyon vuruşu sağlanır. Yapılar hareketliliklerindeki farklılıklara göre ayrışırlar. Belirli halleri enerji verilmiş çarpışmalara sokarak yeni yapılar belirlenebilir ve çeşitli biçimsel değişiklikleri takip edilebilir. Gaz fazındaki biçim değişiklikleri bilgisi sonradan yapıların başlangıçtaki dağılımlarını çıkartmak için haritalandırılabilir. Böylece araştırmacılar yapılar arasındaki olası geçişleri anlayabilir.[24]
Uç boyutlu moleküllerde protein katlanmasının nasıl olduğunun anlaşılması biyolojinin süre gelen sorunlarındandır. Farklı şekillerdeki proteinler genellikle çok farklı biyolojik aktiviteye ve tıbbı yarara sahiptir.[5] Clemmer'in çalışmaları hayat bilimlerinde büyük protein komplekslerinin yapılarının oluşumunun anlaşılması, plazma proteomun profilinin çıkartılması,[13] proteinlerin rollerinin ve nörodejeneratif hastalıklarda protein katlanmasının incelenmesi,[5] kan, idrar ve tükürükten kanserle ilgili olabilecek işaretçilerin belirlenmesi,[4] ilaç keşfinde verimliliğin arttırılması[25] amacıyla kullanılmıştır. İyon hareketliliği-kütle spektrometrisi yöntemleri tek bir analizde birden fazla farklı karakteristiğin ölçülmesi ve ilişkilendirilmesini sağlar. Araştırmacılar bu teknikleri karmaşık biyolojik örnekleri lipidomik, proteomik, glikomik ve metabolomik bilgi edinmek için inceleyebilir.[13]
Şirketler
Clemmer biyolojik sistemler şirketi Beyond Genomics'in kurucu ortağıdır ve kişisel ilaç alanında uzmanlaşmış biyoteknoloji şirketi Predictive Physiology and Medicine'in kurucusudur.[4]
Hobiler
Pek çok müzik aleti çalmanın yanı sıra Clemmer maratonlarda koşmayı sever.[2]
Ödüller
- 2018, John B. Fenn Öne Çıkan Katkı, Martin F. Jarrold[26] ve Gert von Helden ile paylaştı,[27] Amerikan Kütle Spektrometresi Cemiyeti[28]
- 2017, Üye, Ulusal Mucitler Akademisi[29]
- 2014-2015, ANACHEM Ödülü[30]
- 2014, Seçkin Profesör, Indiana Üniversitesi Bloomington[4]
- 2014, Seçkin Kimya Mezunu, Utah Üniversitesi[9]
- 2012, Amerikan Kimya Derneği (ACS) Kimyasal Enstrümantasyon Ödülü[31]
- 2011, Üye, Amerikan Bilimi Geliştirme Derneği (AAAS)[32]
- 2011–2012, Üye, Japon Bilimi Geliştirme Derneği (JSPS)
- 2010, Adams Eyalet Üniversitesi Olağanüstü Mezun[3]
- 2009, Tracy M. Sonneborn Ödülü, Indiana Üniversitesi Bloomington[11]
- 2007, Amerikan Kimya Derneği (ACS) Akron Ödülü[33]
- 2006, Biemann Madalyası, Amerikan Kütle Spektrometresi Cemiyeti[5]
- 2005, Üye, Royal Society of Chemistry
- 2003–2005, Ulusal Bilim Vakfı Özel Yaratıcılık Ödülü
- 2002, Pittcon Başarı Ödülü[34]
- 2002, Popular Science dergisinde En Parlak 10 kişiden biri seçildi[10]
- 2002, Robert ve Marjorie Mann Kimya Kürsüsü Başkanı, Indiana Üniversitesi Bloomington
- 2000–2002, Eli Lilly Analitik Kimya Ödülü
- 1998–2001, Üye, Alfred P. Sloan Research[35]
- 2000, Ulusal Fresenius Ödülü, Phi Lambda Upsilon[36]
- 1999–2000, Amerikan Kimya Derneği (ACS), Analitik Kimya Bölümü, Arthur F. Findeis Ödülü
- 1999, Camille Dreyfus Öğretmen-Akademisyen Ödülü, Camille ve Henry Dreyfus Vakfı[37]
- 1999, "35 Yaş Altı Yenilikçiler", MIT Technology Review[38]
- 1996–2000, Ulusal Bilim Vakfı Erken Kariyer Ödülü
Kaynakça
- ^ a b "Clemmer Group Prof. David E. Clemmer". Indiana University Bloomington. 16 Temmuz 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Nisan 2017.
- ^ a b c d e f g "Professor David Clemmer, Indiana University". Waters The Science of What's Possible. 23 Haziran 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Nisan 2017.
- ^ a b c d Relyea, Linda (26 Ağustos 2010). "Clemmer makes science an art form". Adams State University. 7 Eylül 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Nisan 2017.
- ^ a b c d e "University Honors & Awards: Honoree David E. Clemmer". Indiana University Bloomington. 27 Nisan 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Nisan 2017.
- ^ a b c d e f g h i j Bierbaum, Veronica M.; Fred W. McLafferty (2007). "Focus in Honor of David E. Clemmer, Recipient of the 2006 Biemann Medal". Journal of the American Society for Mass Spectrometry. 18 (7): 1161-1162. doi:10.1016/j.jasms.2007.05.004
 . PMID 17555983. 4 Temmuz 2020 tarihinde kaynağından arşivlendi.
. PMID 17555983. 4 Temmuz 2020 tarihinde kaynağından arşivlendi. - ^ Honma, Kenji; Clemmer, David E. (1995). "The Importance of Electron Transfer Mechanism in Reactions of Neutral Transition Metal Atoms". Laser Chemistry. 15 (2–4): 209-220. doi:10.1155/1995/25319
 .
. - ^ Clemmer, David E.; Jarrold, Martin F. (Haziran 1997). "Ion Mobility Measurements and their Applications to Clusters and Biomolecules". Journal of Mass Spectrometry. 32 (6): 577-592. doi:10.1002/(SICI)1096-9888(199706)32:6<577::AID-JMS530>3.0.CO;2-4.
- ^ Clemmer, David E.; Hudgins, Robert R.; Jarrold, Martin F. (Ekim 1995). "Naked Protein Conformations: Cytochrome c in the Gas Phase" (PDF). Journal of the American Chemical Society. 117 (40): 10141-10142. doi:10.1021/ja00145a037. 21 Nisan 2016 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 1 Mayıs 2017.
- ^ a b "2014 Distinguished Chemistry Alumni Awards". University of Utah. 11 Eylül 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 1 Mayıs 2017.
- ^ a b Hinnefeld, Steve (2002). "'Brilliant 10' scientist credits IU colleagues" (PDF). Hoosier Times. 1 Mayıs 2016 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 2 Mayıs 2017.
- ^ a b c Connelley-Eskine, Cyndi (20 Nisan 2009). "Tracy M. Sonneborn Award recipient and Provost's Professor announced". IU News Room. 16 Mayıs 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Nisan 2017.
- ^ Eiceman, G.A.; Karpas, Z.; Hill, Jr., H.H. (2014). Ion mobility spectrometry (Third bas.). Boca Raton, Fla.: CRC. ss. 30-31. ISBN 9781439859971.
- ^ a b c McLean, John A. (Ekim 2009). "The mass-mobility correlation redux: The conformational landscape of anhydrous biomolecules". Journal of the American Society for Mass Spectrometry. 20 (10): 1775-1781. doi:10.1016/j.jasms.2009.06.016
 . PMID 19646898.
. PMID 19646898. - ^ Shelimov, K.B.; Clemmer, D.E.; Hudgins, R.R.; Jarrold, M.F. (1997). "Protein Structure in Vacuo: The Gas Phase Conformations of BPTI and Cytochrome c". J. Am. Chem. Soc. 119 (9): 2240-2248. doi:10.1021/ja9619059.
- ^ Ibrahim, Yehia M.; Baker, Erin S.; Danielson, William F.; Norheim, Randolph V.; Prior, David C.; Anderson, Gordon A.; Belov, Mikhail E.; Smith, Richard D. (Şubat 2015). "Development of a new ion mobility time-of-flight mass spectrometer". International Journal of Mass Spectrometry. 377: 655-662. doi:10.1016/j.ijms.2014.07.034. PMC 4501404 $2. PMID 26185483.
- ^ "Clemmer Group Development of New Ion Mobility Instrumentation". Indiana University. 8 Eylül 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Mayıs 2017.
- ^ Hoaglund, Cherokee S.; Valentine, Stephen J.; Sporleder, C. Ray; Reilly, James P.; Clemmer, David E. (1998). "Three-Dimensional Ion Mobility/TOFMS Analysis of Electrosprayed Biomolecules" (PDF). Anal. Chem. 70 (11): 2236-2242. doi:10.1021/ac980059c. PMID 9624897. 10 Ağustos 2017 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 1 Mayıs 2017.
- ^ Henderson, Sheila C.; Valentine, Stephen J.; Counterman, Anne E.; Clemmer, David E. (1999). "ESI/Ion Trap/Ion Mobility/Time-of-Flight Mass Spectrometry for Rapid and Sensitive Analysis of Biomolecular Mixtures" (PDF). Anal. Chem. 71 (2): 291-301. doi:10.1021/ac9809175. PMID 9949724. 10 Ağustos 2017 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 1 Mayıs 2017.
- ^ Henderson, Sheila C.; Valentine, Stephen J.; Counterman, Anne E.; Clemmer, David E. (1999). "ESI/Ion Trap/Ion Mobility/Time-of-Flight Mass Spectrometry for Rapid and Sensitive Analysis of Biomolecular Mixtures" (PDF). Anal. Chem. 71 (2): 291-301. doi:10.1021/ac9809175. PMID 9949724. 10 Ağustos 2017 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 1 Mayıs 2017.
- ^ Lanucara, Francesco; Holman, Stephen W.; Gray, Christopher J.; Eyers, Claire E. (21 Mart 2014). "The power of ion mobility-mass spectrometry for structural characterization and the study of conformational dynamics". Nature Chemistry. 6 (4): 281-294. doi:10.1038/nchem.1889. PMID 24651194.
- ^ Gross, Michael L.; Chen, Guodong; Pramanik, Birendra N. (2012). Protein and peptide mass spectrometry in drug discovery. Hoboken, N.J.: Wiley. ss. 202-203. ISBN 978-0-470-25817-0. 6 Temmuz 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Temmuz 2020.
- ^ Hoaglund-Hyzer, Cherokee S.; Counterman, Anne E.; Clemmer, David E. (1999). "Anhydrous Protein Ions" (PDF). Chem. Rev. 99 (10): 3037-3079. doi:10.1021/cr980139g. PMID 11749510. 9 Şubat 2018 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 1 Mayıs 2017.
- ^ Shvartsburg, Alexandre A. (2008). Differential Ion Mobility Spectrometry: Nonlinear Ion Transport and Fundamentals of FAIMS. Boca Raton, Fla.: CRC Press. ss. 25-26.
- ^ "Spectroscopy Society of Pittsburgh January Meeting, 2013". Spectroscopy Society of Pittsburgh. 4 Temmuz 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Mayıs 2017.
- ^ "David Clemmer, 34 Indiana University". Innovators Under 35: 1999. MIT Technology Review. 15 Mart 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Nisan 2017.
- ^ "MFJ Research Group". 26 Mayıs 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Temmuz 2020.
- ^ "Gert von Helden Group". 15 Ocak 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Temmuz 2020.
- ^ "ASMS John B. Fenn Distinguishing Contribution". 21 Mayıs 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Temmuz 2020.
- ^ "National Academy of Inventors Fellows Page". 28 Ocak 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Temmuz 2020.
- ^ "Awards ANACHEM". 15 Ağustos 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Temmuz 2020.
- ^ "DAC Award in Chemical Instrumentation". American Chemical Society (ACS). ACS Division of Analytical Chemistry. 24 Nisan 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Nisan 2017.
- ^ "Record 10 faculty members receive Fellow distinction from AAAS, world's largest scientific society". Inside IU. 1 Aralık 2011. 4 Haziran 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Temmuz 2020.
- ^ "Akron Section Award". 2 Ağustos 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Temmuz 2020.
- ^ "Pittcon 2002".
- ^ "Sloan Research Fellowships". 26 Ekim 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Temmuz 2020.
- ^ "The National Fresenius Award". Northwestern University. 22 Nisan 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 1 Mayıs 2017.
- ^ "Camille Dreyfus Teacher-Scholar Awards Program" (PDF). Camille Dreyfus Foundation. 21 Kasım 2008 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 28 Nisan 2017.
- ^ "David Clemmer, 34 Indiana University". Innovators Under 35: 1999. MIT Technology Review. 15 Mart 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Nisan 2017.
Dış başlantılar
- http://www.indiana.edu/~clemmer/home.htm 8 Ocak 2012 tarihinde Wayback Machine sitesinde arşivlendi.
- David E. Clemmer, Google Akademik tarafından dizinlenen yayınlar











