Kromatografi, bir karışımın bileşenlerini, bunlara seçimsel ilgi gösteren iki ya da daha çok evreden sistemler arasında farklı göçlerine bakarak tanımak, gerektiğinde niceliklerini belirlemek amacıyla yapılan ve ayırma işlemine dayanan analitik yöntemdir.

Kaynama noktası, sıvının buhar basıncının dış basınca eşit olduğu andaki sıcaklığıdır. Buhar basıncı yüksek olan sıvılar uçucudur ve kaynama noktaları düşüktür. Vakum işlemiyle buhar basıncı arttırılarak, kaynama noktası yüksek olan sıvılar oda sıcaklığında kaynatılabilir.
- Kaynama noktasına göre elementler
- Kaynama noktasına göre bazı çözücüler

Çözelti ya da solüsyon, iki ya da daha fazla maddenin herhangi bir oranda bir araya gelerek oluşturdukları homojen karışımdır.

Buharlaştırıcı, kaynama noktası farkından yararlanarak karışımları birbirinden ayırmayı sağlayan bir endüstriyel ekipmandır. Buharlaştırıcılar bir çözeltideki çözücü maddeyi veya bir sıvı karışımdaki daha düşük kaynama noktasına sahip bileşeni buharlaştırarak uzaklaştırılmasını sağlar. Neredeyse bütün endüstriyel işlemlerde çözücü bileşen sudur, suyun uzaklaştırılmasıyla daha derişik bir karışım elde edilmiş olur. Sıvı halde kalan derişik karışım genelde üründür. Buharlaşan bileşen su ise oluşan su buharı atmosfere verilebilir ya da içerdiği ısı sebebiyle endüstriyel süreçlerde tekrar kullanılabilir. Buharlaşan bileşen eğer su haricinde bir çözücü maddeyse değerli olduğundan ötürü uzaklaştırılmaz ve tekrar kullanılır.
Kaynama, sıvının buhar basıncının dış basınca eşit olduğunda, sıvının her yerinden gaz kabarcıklarının çıkması. Saf maddelerin sabit atmosfer basıncı altında kaynama noktası sabittir. Kaynama süresi boyunca maddenin sıcaklığı değişmez. Sıvı bir maddenin içine uçucu olmayan bir çözünen eklenirse çözeltinin kaynama noktası yükselir. Çözünen madde miktarı arttıkça kaynama noktası yükselecektir. Aynı ortamdaki bütün sıvıların kaynama anındaki buhar basınçları eşittir, ancak maddelerin kaynama sıcaklığı maddenin cinsine, saflığına ve ortamın dış basıncına bağlıdır. Kaynama sıcaklığı maddeler için ayırt edici bir özelliktir.

Uçucu yağ ya da organik hidrosol, çiçek veya bitki özsuları, distile özsuları veya bitki suları olup damıtma işleminin su içeren bir yan ürünüdür.

Kuru temizleme, kumaşların üzerinde bulunan kir ve lekeleri çıkarmak için su içermeyen apolar bir çözücü kullanılarak yapılan yıkama işlemidir. Dünya çapında genel olarak kuru temizlemede tetrakloroetilen isimli toksisitesi düşük ve yanıcı olmayan bir sıvı kullanılır. Yapısı polar olan su kullanan ıslak temizlemeden farklıdır, yine de sıvı içerir, ancak giysiler bunun yerine su içermeyen bir sıvıyla yıkanır.
Çözücü veya solvent bir katıyı, sıvıyı ya da gaz çözünen maddeyi çözerek çözelti oluşturan sıvı ya da gaz maddedir. Günlük hayatta en yaygın çözücü sudur.
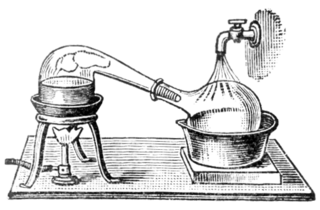
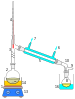
Ayrımsal damıtma, kaynama noktaları birbirinden farklı sıvıların karışımlarına uygulanan damıtma işlemidir. Sıvı+sıvı çözeltiler için kullanır. Çözelti damıtma kabında ısıtılınca, kaynama noktası düşük olan sıvı kaynayarak karışımdan ayrılır. Tekrar sıvılaştırılarak başka bir kap içinde biriktirilir ve böylece ayrım işlemi tamamlanmış olur. Erken kaynayarak ayrışan sıvının soğutularak yeniden yoğuşturulması için genellikle su kullanılır.

Gaz kromatografisi, ayrışmadan buharlaşabilen bileşiklerin ayrımı ve analizi için analitik kimyada kullanılan kromatografinin yaygın bir türüdür. Buhar-fazı kromatografisi ve gaz-sıvı ayırma kromatografisi olarak da bilinir. Yaygın olarak, belirli bir maddenin saflığını test etmek veya farklı bileşenlerden oluşan bir karışımı ayırmak için kullanılır. Bazı durumlarda, bir bileşiğin belirlenmesinde de yardımcı olabilir. Preparatif kromatografide bir karışımdan saf bileşikler elde etmek için kullanılabilir.

Yoğunlaşma veya yoğuşma, maddenin fiziksel halinin gaz fazından sıvı faza değişimi ve buharlaşmanın tersidir. En sık su döngüsü anlamında kullanılır. Atmosfer içinde bir sıvı veya katı bir yüzey veya Yoğunlaşma bulutu ile temas ettiğinde, su buharının sıvı suya değişmesi olarak da tanımlanabilir. Doğrudan gaz fazdan katı faza geçiş gerçekleştiğinde, değişime kırağılaşma denir.

Fiziksel bilimlerde faz; bir malzemenin fiziksel özelliklerinin her noktasında aynı olduğu bölgedir/alandır. Fiziksel özelliklerinin örneklerinden üç tanesi, yoğunluk içermesi, mıknatıslanma ve kimyasal bileşimi indeksi. Basit bir açıklama ile bir faz fiziksel olarak ayrı, kimyasal olarak yeknesak ve (genellikle) mekanik ayrılabilir malzemeli bir bölge olmasıdır. Bir cam kavanoz buz ve sudan oluşan bir sistemde, buz küpleri birinci faz, su ikinci faz ve suyun üstünde bulunan nem ise üçüncü fazdır. Cam kavanoz ise başka bir ayrı aşamasıdır. Faz terimi bazen maddenin hali olarak eş anlamlı bir şekilde kullanılabilir. Ancak bir maddenin aynı halde çok sayıda karışmayan fazı olabilir. Ayrıca, faz terimi bazen bir faz diyagramı için üzerinde sınır ile basınç ve sıcaklık gibi durum değişkenler açısından sınırı çizilmiş denge durumunda bir dizi oluşturmak için kullanılır. Faz sınırları gibi katı veya başka bir kristal yapısından daha ince değişikliğine sıvıdan bir değişiklik olarak maddenin organizasyon değişiklikleriyle ilgili olduğundan bu son kullanım durumuna eş anlamlısı olarak "faz" kullanımına benzer. Ancak, madde ve faz diyagramı kullanımların hali yukarıda verilen ve amaçlanan anlam terim kullanıldığı bağlamdan kısmen tespit edilmelidir resmi tanımı ile orantılı değildir. Fazın çeşitleri Farklı fazlar, gaz, sıvı, katı, plazma veya Bose-Einstein yoğuşma ürünü olarak maddenin farklı durumlar olarak tarif edilebilir. Maddenin katı ve sıvı formda diğer haller arasındaki faydalı mezofazlar.

Kimyada, uçuculuk bir maddenin ne kolaylıkta buharlaştığını tanımlayan bir özelliktir. Belirli bir sıcaklık ve basınçta, yüksek uçuculuğa sahip bir maddenin buhar olarak bulunma olasılığı daha yüksekken, düşük uçuculuğa sahip bir maddenin sıvı ya da katı olma olasılığı daha yüksektir. Uçuculuk, bir buharın sıvı veya katı hâline yoğunlaşma eğilimini de tarif edebilir; daha az uçucu madde, yüksek uçucu maddelere göre buhardan daha kolay yoğunlaşacaktır. Uçuculuktaki farklılıklar, bir madde grubunun atmosfere açık olduğunda ne kadar hızlı buharlaştığını karşılaştırarak görülebilir. İspirto gibi yüksek derecede uçucu bir madde hızlı bir şekilde buharlaşırken, bitkisel yağ gibi düşük uçuculuğa sahip bir madde yoğuşmuş kalacaktır. Genel olarak, katılar sıvılardan daha az uçucudur, ancak bazı istisnalar da vardır. Kuru buz veya iyot gibi süblimleşen katı maddeler standart koşullar altında bazı sıvılarla aynı oranda buharlaşabilir.

Uçucu bir maddenin parlama noktası, bir tutuşturma kaynağı verildiğinde, madde buharının tutuşacağı en düşük sıcaklıktır.

Ayırma işlemi, bir kimyasal madde karışımını en az iki veya daha fazla ürüne dönüştürmek için kullanılan yönteme verilen addır. Ayırma işlemi sonucunda oluşan ürünlerden en az biri, kaynaktaki bileşenlerden en az biri ya da birden fazlası bakımından zenginleşir. Bazı durumlarda karışımlar bir ayırma işlemiyle neredeyse tamamen saf iki bileşene ayırabilir. Karışımın bileşenleri arasındaki fiziksel veya kimyasal farklarından yararlanılarak ayırma gerçekleştirilir.

Yüksek performanslı sıvı kromatografisi bir analitik kimya yöntemidir. Karışımlardaki bileşenlerin, ayrıştırılmasında, nitelik ve niceliklerinin belirlenmesinde kullanılan bir analiz tekniğidir. Bu teknikte pompalar ile pompalanan yüksek basincli sıvı faz aracılığıyla taşınan analitler, kromatografik kolona ulaşır. Kolona ulaşan analitler, kolon ile farklı şekillerde etkileşip, farklı zamanlarda detektöre ulaşırlar. Burada, kolon katı bir adsorbent maddeyle doludur ki bu maddenin özellikleri sayesinde kromatografik ayrışma gerçekleşir.
Katı hâl kimyası, bazen malzeme kimyası olarak da adlandırılır, katı faz malzemelerinin, özellikle, ancak sadece moleküler olmayan katıların sentezi, yapısı ve özelliklerinin incelenmesidir. Bu nedenle, katı hal fiziği, mineraloji, kristalografi, seramik, metalurji, termodinamik, malzeme bilimi ve elektronik ile yeni malzemelerin sentezine ve karakterizasyonuna odaklanan güçlü bir örtüşmeye sahiptir. Katılar, ana partiküllerinin düzenlenmesinde mevcut olan düzenin doğasına göre kristal veya amorf olarak sınıflandırmak mümkündür.

Koku çıkarma, damıtma, eleme gibi yöntemler kullanılarak hammaddelerden aromatik bileşiklerin ayırma işlemidir. Özütlerin sonuçları, özü çıkarılan üründeki mum miktarına bağlı olarak ya uçucu yağlar, konsantre ve kokulu uçucu yağlar ,yarı katı kütleler ya da bitkisel yağ'lardır. Bir dereceye kadar tüm bu teknikler hammaddelerin aromasından farklı aromalı öz üretme eğilimindedir. Özüt çıkarma işleminde ısı, kimyasal çözücüler veya oksijene maruz kalma, bazı aromatik bileşiklerin koku karakterini değiştirerek veya onları kokusuz hale getirerek yapay hale getirebilir ve özü alınan her aromatik bileşenin oranı farklı olabilir.

Modern öncesi kimya ve simyada kohobasyon, aynı maddenin sıvı ile tekrar tekrar damıtılmasıydı; o sıvı kabın tabanında kalan maddenin üzerine tekrar tekrar dökülüyor. Kohobasyon bir tür sirkülasyondur, ondan tek farkı sıvı maddenin ortak damıtmada olduğu gibi kohobasyonda çekilmesi ve tekrardan geri atılmasıdır; oysa dolaşımda, hiç dışarı çekilmeden aynı kapta yükselir ve alçalır.
Bir azeotrop veya eşkaynar, oranları değiştirilemeyen veya basit damıtma ile ayrılamayan iki veya daha fazla sıvı karışımıdır.