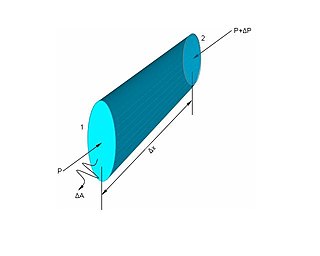
Basınç, bir yüzey üzerine etkide bulunan dik kuvvetin, birim alana düşen miktarı. Katı, sıvı ve gazlar ağırlıkları nedeniyle bulundukları yüzeye bir kuvvet uygularlar. Kuvvetin kaynağı ne olursa olsun birim yüzeye dik olarak etki eden kuvvete basınç (P), bütün yüzeye dik olarak etki eden kuvvete de basınç kuvveti (F) denir.

İdeal gaz yasası, sadece teoride olan ideal gazların durumları hakkında denklemler sağlayan bir yasadır. Bir miktar gazın durumu; basıncı, hacmi ve sıcaklığına göre belli olur. Bu denklem aşağıdaki gibidir:

- P paskal olarak basınç,
- V kübik metre olarak hacim,
- n gazın mol sayısı,
- R gaz sabiti
- T Kelvin olarak sıcaklık

Termodinamik çevrim, bir veya daha çok hal değişimi gerçekleştiren, iş veya enerji üreterek veya enerjiyi transfer ederek ilk haline dönen bir çalışma akışkanı içeren çevrimlerdir. Tabloda termodinamik çevrimlerin listesi verilmiştir.

Çözelti ya da solüsyon, iki ya da daha fazla maddenin herhangi bir oranda bir araya gelerek oluşturdukları homojen karışımdır.
Kimya yasaları, kimya ile ilgili olan doğa yasalarıdır.

Fizik, fiziksel kimya ve mühendislikte akışkanlar dinamiği, akışkanların akışını tanımlayan akışkanlar mekaniğinin bir alt disiplinidir. Aerodinamik ve hidrodinamik dahil olmak üzere çeşitli alt disiplinleri vardır. Akışkanlar dinamiğinin, uçaklardaki kuvvetlerin ve momentlerin hesaplanması, boru hatları boyunca petrolün Kütle akış hızının belirlenmesi, hava durumu modellerinin tahmin edilmesi, uzaydaki bulutsuların anlaşılması ve fisyon silahı patlamasının modellenmesi dahil olmak üzere geniş bir uygulama yelpazesi vardır.
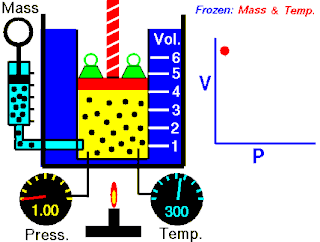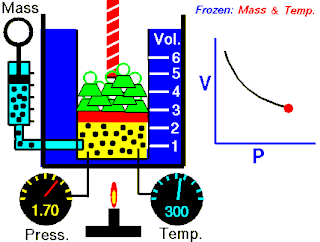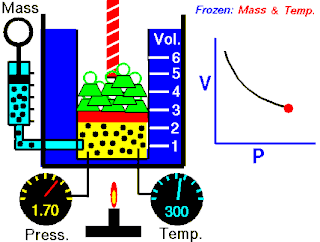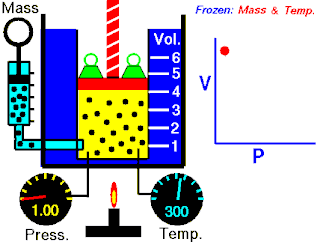
Boyle yasası, gaz yasalarından biridir. 1662'de İrlandalı doğa filozofu Robert Boyle tarafından ilk defa basılmıştır. Yasa, Richard Towneley ve Henry Power tarafından Boyle'ın önüne getirilmiş ve Boyle da deneyleri yapıp sonuçları basmıştır. Robert Gunther ve bazı diğer otoritelere göre, deneyin aparatını hazırlayan Boyle'ın asistanı Robert Hooke, yasayı formülize eden insan olabilir. Hooke'un matematik konusundaki becerileri Boyle'ı aşıyordu. Hooke ayrıca, deneyler için gerekli olan vakum pompalarını da icat etmiştir. Fransız fizikçi Edme Mariotte (1620-1684), Boyle'dan bağımsız olarak formülü 1676'da bulmuştur. Bu nedenle de bu yasa, Mariotte ya da Mariotte-Boyle yasası olarak da isimlendirilebilir.

Gaz yasaları, gazlardaki termodinamik sıcaklık (T), basınç (P) ve hacim (V) aralarındaki ilişkileri açıklayan bir takım kanundur. Rönesans'ın geç dönemleriyle 19. yüzyıl arasındaki dönemde bulunmuş birkaç yasadan oluşur.
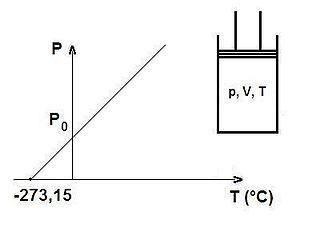
Charles yasası, gaz yasalarından biridir. Bu yasaya göre, sabit basınçta, herhangi bir miktardaki ideal gazın hacminin azalıp çoğalması, aynı oranda sıcaklığının da azalıp çoğalmasını etkiler.

Gay-Lussac yasası, Fransız kimyacı Joseph Louis Gay-Lussac'ın adıyla anılır. Gay-Lussac'a mal edilen, iki tane gaz yasası vardır. İkisi de aynı isimle anılırlar. En ünlü deneyi gazlarla yaptığı sıcaklık değişiminin inciler üzerindeki basınç değişimini dedesi Mark Lussac ile yapmıştır.
Avogadro yasası ya da Avogadro hipotezi, Amedeo Avogadro'nun 1811'de bulduğu bir gaz yasasıdır. Bu yasa, eşit hacimdeki gazların; eşit sıcaklık ve eşit basınçta aynı sayıda parçacık ya da molekül sayısına sahip olduğunu öne sürer. Buna göre, belirli bir hacimdeki gazın bulundurduğu molekül sayısı, gazın kütle ya da boyutundan bağımsızdır. Örnek olarak, aynı hacimdeki hidrojen ve nitrojen verilebilir. Buna göre, hidrojen de nitrojen de, aynı hacim, aynı basınç ve aynı sıcaklıkta aynı molekül sayısına sahiptir.
Bir ideal gaz karışımında hacmi olan her gazın kendine ait bir kısmi basıncı vardır.

Düdüklü tencere, yemekleri hızlı pişirmek için buhar ve yüksek basınç yararlanma prensibi ile çalışan tencere. Basınçla suyun kaynama derecesi arasındaki ilişkiden hareketle ortaya çıkmıştır. Düdüklü tencere yemekleri yüksek sıcaklıkta ve tamamen kapalı hâlde pişirdiğinden, yemeklerin pişme süresini en aza indiren, subap ile belirli bir kaynama noktasına ayarlanmış tenceredir. Düdüklü tencerelerde patlama tehlikesine karşı, basınca, dolayısıyla pişme derecesine göre ayarlanabilen bu subap, basınç artınca düdük hava kaçırarak tencerenin patlamasına engel olur. Düdüklü tencere ismini de bu nedenle almıştır.
Kinetik teori veya gazların kinetik teorisi, gazların basınç, sıcaklık, hacim gibi makroskobik özelliklerini moleküler bileşim ve hareketlerine bağlı olarak açıklayan teoridir. Esas olarak, teori Isaac Newton'un kanısının tersine basıncın moleküller arası statik itmeden kaynaklanmadığını, bunun yerine belli hızlarda hareket eden moleküller arası çarpışmalardan kaynaklandığını söyler. Kinetik teori aynı zamanda kinetik-moleküler teori veya çarpışma teorisi olarak da bilinir.

Termodinamik ve istatistiksel fizik ile ilgili olayların kronolojisidir.

Joule genişlemesi termodinamikte (ısıdevinimsel) geri dönülmez (tersinemez) bir süreçtir. Burada ısısal olarak yalıtılmış bölmeli kabın bir tarafına belli bir hacimde gaz konur, kalan diğer tarafı ise boşaltılmıştır. Kabın ortasındaki engel kaldırılır ve bir taraftaki gaz tüm kaba yayılır.

Maxwell ilişkileri İkinci dereceden türevlerin simetri ve termodinamik potansiyellerin tanımlarından türetilebilen termodinamik denklemler dizisidir. Bu ilişkiler 19.yüzyıl fizikçisi James Clerk Maxwell tarafından adlandırılmıştır.
Kimya ve biyokimyada ayrışma, moleküllerin (veya tuzlar veya bileşikler gibi iyonik bileşiklerin) atomlar, iyonlar veya radikaller gibi daha küçük parçacıklara ayrıldığı genel bir süreçtir. Örneğin, bir asit suda çözündüğünde, bir elektronegatif atom ile bir hidrojen atomu arasındaki kovalent bir bağ, bir proton (H+) ve bir negatif iyon veren heterolitik fisyon tarafından kırılır. Ayrışma, birleşme veya rekombinasyonun tersidir.
Termodinamikte izovolümetrik süreç veya izometrik süreç olarak da adlandırılan izokorik süreç kapalı sistem hacminin sabit kalması demektir. İzokorik bir süreç, kapalı, elastik olmayan bir kabın içeriğinin ısıtılması veya soğutulması ile örneklendirilebilir. Kapalı sistem kabın içeriğinin dışarıya karşı izole olmasıdır. Kap deforme olmaz ve hacmi termodinamik süreç boyunca sabit kalırsa bu bir izokorik süreç örneğidir.



















