Dörtyüzlü moleküler geometri
 | |
| Örnek | CH4, MnO4- |
|---|---|
| Nokta grubu | Td |
| Koordinasyon numarası | 4 |
| Bağ açıları | ≈109.5° |
| μ (Polarite) | 0 |
Dörtyüzlü veya tetrahedral molekül geometrisi, merkezi atomun, dört yüzlünün ortasında, dört köşede ise sübstitüentlerin yer aldığı molekül geometrisidir. Bağ açıları, dört sübstitüent aynı olduğunda (örn. metan CH4 ya da daha ağır analogları) cos−1 (-⅓) = 109,4712206 ...° ≈ 109.5° olur.[1][2] Metan veya diğer simetrik yüzlü moleküller Td nokta grubuna aittir, ama dörtyüzlü moleküller genellikle düşük simetriye sahiptir. Tetrahedral moleküller kiral olabilir.
Örnekler
Ana grup kimyası

Hemen hemen tüm doymuş organik bileşiklerin yanı sıra, Si, Ge ve Sn bileşiklerinin çoğu dörtyüzlüdür. Genellikle dörtyüzlü moleküller, dış ligandlara çoklu bağlama özelliği gösterir örn, ksenon tetroksit (XeO4), perklorat iyonu (ClO4-), sülfat iyonu (SO4−2), fosfat iyonu (PO4−3). Tiazil triflorür (SNF3) bir sülfür-azot üçlü bağı içeren, dört yüzlü bir moleküldür.[3]
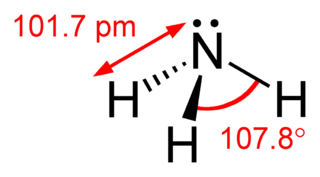
Diğer moleküller, merkezi bir atomun etrafındaki elektron çiftlerinin tetrahedral düzenlemesine sahiptir; örneğin amonyak (NH3), üç hidrojen ve bir yalın çifti azot atomunu çevreler. Fakat, olağan sınıflandırma sadece bağlanmış atomları dikkate alır, yalın çiftleri dikkate almaz. Bu sebeple amonyak piramidal olarak kabul edilir. H - N - H açıları 109°'den sapar 107° olur. Bu fark, bağlanmış bir atomdan daha büyük itici etki uygulayan yalın çiftin etkisi sebebiyledir.
Geçiş metali kimyası
Geometri, özellikle metalin d0 veya d10 konfigürasyonuna sahip olduğu kompleksler için yaygındır. Açıklayıcı örnekler arasında tetrakis(trifenilfosfin)paladyum(0) (Pd[P(C6H5)3]4), nikel karbonil (Ni(CO)4) ve titanyum tetraklorür (TiCI4) bulunmaktadır. Tamamen doldurulmamış d-kabuklarına sahip birçok kompleks genellikle dörtyüzlüdür, örneğin demir (II), kobalt(II) ve nikel(II) tetrahalidleri.
Su yapısı
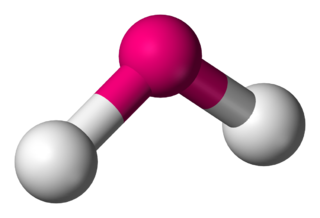
Gaz fazında, tek bir su molekülü, iki hidrojen ve iki yalın çifti ile çevrili bir oksijen atomuna sahiptir ve H2O geometrisi yalın çiftleri gözetmeksizin sadece açısal olarak belirtilir.
Bununla birlikte, sıvı suda ya da buzda, yalnız çiftler, komşu su molekülleriyle hidrojen bağları oluşturur. Bir oksijen etrafındaki hidrojen atomlarının en yaygın düzenlemesi, oksijene kovalent olarak bağlanmış iki hidrojen atomu ve ikisi hidrojen bağlarıyla yalın çiftlere bağlı dörtyüzlüdür. Hidrojen bağlarının uzunlukları değiştiğinden, bu su moleküllerinin çoğu simetrik değildir ve bu dört hidrojen atomu aralarında geçici düzensiz dörtyüzlü oluştururlar.[4]
Çift dörtyüzlü yapılar
Birçok bileşik ve kompleks, çift dörtyüzlü yapı benimser. Bu motifde, iki dörtyüzlü ortak bir kenarı paylaşır. İnorganik polimer silikon disülfür, sonsuz bir kenar paylaşımlı dörtyüzlü zincirine sahiptir.

İstisnalar ve bozulmalar
Dörtyüzlünün tersyüz olduğu durumlar organik ve ana grup kimyasında yaygın olarak ortaya çıkar. Walden tersinmesi denilen karbon tersinmesinin stereokimyasal sonuçlarını göstermektedir. Amonyakta azot tersinmesi de NH3'ün düzlemsel geçici oluşumunu gerektirir.
Ters dörtyüzlü geometri
Bir moleküldeki geometrik kısıtlamalar, idealize edilmiş dörtyüzlü geometrinin ciddi şekilde bozulmasına neden olabilir. Bir karbon atomunda "ters" dörtyüzlü geometriye sahip bileşiklerde, bu karbona bağlı dört grubun hepsi bir düzlemin bir tarafındadır.[5] Karbon atomu köşedeki diğer dört grupla birlikte kare bir piramidin tepesinde ya da yakınında yatar.[6][7]

Ters dörtyüzlü geometriyi gösteren organik moleküllerin basit örnekleri, [[[1.1.1] propelan]] gibi küçük propelanlar veya daha genel olarak padlan,[8] ve piramidan ([3.3.3.3] fenestran).[7][7] Bu tür moleküller tipik olarak süzülerek reaktivitenin artmasına neden olur.
Düzlemleşme
Bir dörtyüzlü, iki bağ arasındaki açıyı artırarak da bozulabilir. Aşırı durumda, düzleşme ile sonuçlanır. Karbon için bu fenomen, fenestranlar adı verilen bir bileşik sınıfında gözlenebilir.
Merkez atomu olmayan dörtyüzlü moleküller
Birkaç molekül, merkezi atom içermeyen bir dörtyüzlü geometriye sahiptir. Bir inorganik örnek olan tetrafosfor (P4) her birine diğer üç fosforun bağlı olduğu bir dörtyüzlüden oluşturur. Organik bir örnek tetrahedran (C4H4), her biri hidrojene ve diğer üç karbon atomuna bağlanmış dört karbon atomundan oluşur.
Ayrıca bakınız
- AXE yöntemi
- Orbital hibridizasyon
Kaynakça
- ^ "Angle Between 2 Legs of a Tetrahedron" 3 Ekim 2018 tarihinde Wayback Machine sitesinde arşivlendi.. Maze5.net.
- ^ Brittin, W. E. (1945). "Valence Angle of the Tetrahedral Carbon Atom". Journal of Chemical Education 22 (3): 145. Bibcode:1945JChEd..22..145B. doi:10.1021/ed022p145.
- ^ Miessler, G. L.; Tarr, D. A. Inorganic Chemistry (3rd ed.). Pearson/Prentice Hall. ISBN 0-13-035471-6.
- ^ Mason, P. E.; Brady, J. W. (2007). ""Tetrahedrality" and the Relationship between Collective Structure and Radial Distribution Functions in Liquid Water". J. Phys. Chem. B. 111(20): 5669–5679. doi:10.1021/jp068581n. 23 Nisan 2019 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ Wiberg, Kenneth B. (1984). "Inverted geometries at carbon". Accounts of Chemical Research 17 (11): 379–386. doi:10.1021/ar00107a001. 23 Nisan 2019 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ Joseph P. Kenny; Karl M. Krueger; Jonathan C. Rienstra-Kiracofe; Henry F. Schaefer III (2001). "C5H4: Pyramidane and Its Low-Lying Isomers". J. Phys. Chem. A. 105 (32): 7745–7750. Bibcode:2001JPCA..105.7745K. doi:10.1021/jp011642r 23 Nisan 2019 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ a b c Lewars, E. (1998). "Pyramidane: an ab initio study of the C5H4 potential energy surface". Journal of Molecular Structure: THEOCHEM. 423 (3): 173–188. doi:10.1016/S0166-1280(97)00118-8 23 Nisan 2019 tarihinde Wayback Machine sitesinde arşivlendi. Kaynak hatası: Geçersiz
<ref>etiketi: "Lewars" adı farklı içerikte birden fazla tanımlanmış (Bkz: ) - ^ IUPAC, Compendium of Chemical Terminology, 2. basım (the "Gold Book") (1997). Düzeltilmiş çevrimiçi sürümü: (2006-) "paddlanes".
Dış bağlantılar
- Tetrahedral molekül örnekleri
- Hareketli Tetrahedral Visual3 Kasım 2012 tarihinde Wayback Machine sitesinde arşivlendi.
- Elmhurst Koleji
- Nokta grupları için etkileşimli moleküler örnekler
- 3D Chem18 Nisan 2019 tarihinde Wayback Machine sitesinde arşivlendi. - Kimya, Yapılar ve 3D Moleküller
- IUMSC - Indiana Üniversitesi Moleküler Yapı Merkezi]
- [1]
- Moleküler Modelleme