
Newton'un hareket yasaları, bir cisim üzerine etki eden kuvvetler ve cismin yaptığı hareket arasındaki ilişkileri ortaya koyan üç yasadır. İlk kez Isaac Newton tarafından 5 Temmuz 1687 tarihinde yayımlanan Philosophiae Naturalis Principia Mathematica adlı çalışmada ortaya konmuştur. Bu yasalar klasik mekaniğin temelini oluşturmuş, bizzat Newton tarafından fiziksel nesnelerin hareketleri ile ilgili birçok olayın açıklanmasında kullanılmıştır. Newton, çalışmasının üçüncü bölümünde, bu hareket yasalarını ve yine kendi bulduğu evrensel kütleçekim yasasını kullanarak Kepler'in gezegensel hareket yasalarının elde edilebileceğini göstermiştir.
- 1. Yasa
- Eylemsiz referans sistemi adı verilen öyle referans sistemleri seçebiliriz ki, bu sistemde bulunan bir parçacık üzerine bir net kuvvet etki etmiyorsa cismin hızında herhangi bir değişiklik olmaz. Bu yasa genellikle şu şekilde basitleştirilir: “Bir cisim üzerine dengelenmemiş bir dış kuvvet etki etmedikçe, cisim hareket durumunu korur.”
- 2. Yasa
- Eylemsiz bir referans sisteminde, bir parçacık üzerindeki net kuvvet onun çizgisel momentumunun zaman ile değişimi ile orantılıdır:


İdeal gaz yasası, sadece teoride olan ideal gazların durumları hakkında denklemler sağlayan bir yasadır. Bir miktar gazın durumu; basıncı, hacmi ve sıcaklığına göre belli olur. Bu denklem aşağıdaki gibidir:

- P paskal olarak basınç,
- V kübik metre olarak hacim,
- n gazın mol sayısı,
- R gaz sabiti
- T Kelvin olarak sıcaklık
Benzinli motorda, yanma sabit hacimde gerçekleşir, dizel motorda ise yanma sabit basınçta gerçekleşir. Karma çevrimde ise günümüz modern dizel motorlarında olduğu gibi, yanmanın ilk aşaması sabit hacime yakın, son aşaması ise sabit basınca yakın gerçekleşmektedir. Bu yüzden ısının bir miktarının sabit hacimde, geri kalan kısmının da sabit basınçta sisteme verildiği bu çevrime karma çevrim denir.
Kimya yasaları, kimya ile ilgili olan doğa yasalarıdır.
Sabit hacim çevrimleri, buji ile ateşlemeli motorlarda kullanılan, ateşlemenin piston üst ölü noktaya geldiği ve sıkıştırma sonu basıncının en üst seviyeye çıktığı anda bujilerden kıvılcım çaktırılarak yapılan bunun sonucunda da pistonu aşağıya iten maksimum basıncın elde edildiği çevrimlerdir. Sabit basınç ya da dizel çevrimlerinden farkı ateşleme sabit bir hacimde yapılması ve buji kullanılmasıdır. Sabit hacim derken, dizel çevrimlerinde olduğu gibi piston aşağıya doğru inerken sisteme ısı girişi yapılmamaktadır.

Genleşme, sıcaklığı artırılan bir cismin uzunluk ya da hacminin değişmesi olayıdır.
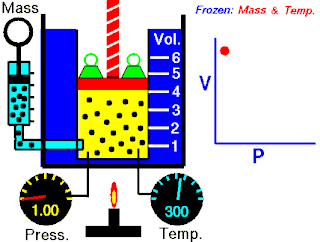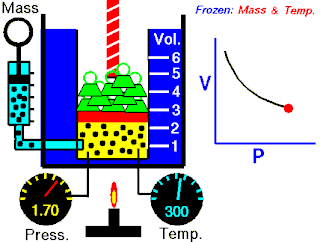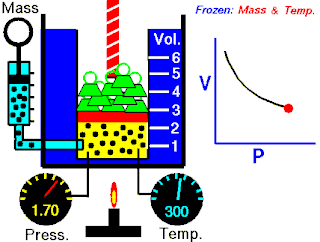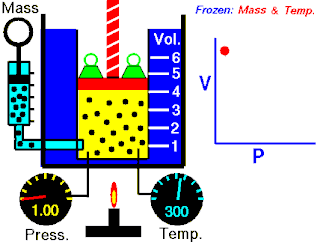
Boyle yasası, gaz yasalarından biridir. 1662'de İrlandalı doğa filozofu Robert Boyle tarafından ilk defa basılmıştır. Yasa, Richard Towneley ve Henry Power tarafından Boyle'ın önüne getirilmiş ve Boyle da deneyleri yapıp sonuçları basmıştır. Robert Gunther ve bazı diğer otoritelere göre, deneyin aparatını hazırlayan Boyle'ın asistanı Robert Hooke, yasayı formülize eden insan olabilir. Hooke'un matematik konusundaki becerileri Boyle'ı aşıyordu. Hooke ayrıca, deneyler için gerekli olan vakum pompalarını da icat etmiştir. Fransız fizikçi Edme Mariotte (1620-1684), Boyle'dan bağımsız olarak formülü 1676'da bulmuştur. Bu nedenle de bu yasa, Mariotte ya da Mariotte-Boyle yasası olarak da isimlendirilebilir.

Gaz yasaları, gazlardaki termodinamik sıcaklık (T), basınç (P) ve hacim (V) aralarındaki ilişkileri açıklayan bir takım kanundur. Rönesans'ın geç dönemleriyle 19. yüzyıl arasındaki dönemde bulunmuş birkaç yasadan oluşur.
Gay-Lussac yasası, Fransız kimyacı Joseph Louis Gay-Lussac'ın adıyla anılır. Gay-Lussac'a mal edilen, iki tane gaz yasası vardır. İkisi de aynı isimle anılırlar. En ünlü deneyi gazlarla yaptığı sıcaklık değişiminin inciler üzerindeki basınç değişimini dedesi Mark Lussac ile yapmıştır.
Avogadro yasası ya da Avogadro hipotezi, Amedeo Avogadro'nun 1811'de bulduğu bir gaz yasasıdır. Bu yasa, eşit hacimdeki gazların; eşit sıcaklık ve eşit basınçta aynı sayıda parçacık ya da molekül sayısına sahip olduğunu öne sürer. Buna göre, belirli bir hacimdeki gazın bulundurduğu molekül sayısı, gazın kütle ya da boyutundan bağımsızdır. Örnek olarak, aynı hacimdeki hidrojen ve nitrojen verilebilir. Buna göre, hidrojen de nitrojen de, aynı hacim, aynı basınç ve aynı sıcaklıkta aynı molekül sayısına sahiptir.
Kinetik teori veya gazların kinetik teorisi, gazların basınç, sıcaklık, hacim gibi makroskobik özelliklerini moleküler bileşim ve hareketlerine bağlı olarak açıklayan teoridir. Esas olarak, teori Isaac Newton'un kanısının tersine basıncın moleküller arası statik itmeden kaynaklanmadığını, bunun yerine belli hızlarda hareket eden moleküller arası çarpışmalardan kaynaklandığını söyler. Kinetik teori aynı zamanda kinetik-moleküler teori veya çarpışma teorisi olarak da bilinir.

Dalton yasası, bir gaz karışımının toplam basıncının, karışımı oluşturan gazların kısmi basınçlarının toplamına eşit olduğunu açıklayan bir fiziksel kimya yasasıdır. Bu ampirik yasa John Dalton tarafından 1801 yılında deneysel olarak gözlemlenmiş ve 1802 yılında yayımlanmıştır. Dalton yasası ideal gaz kanunlarıyla ilgilidir.

Joule genişlemesi termodinamikte (ısıdevinimsel) geri dönülmez (tersinemez) bir süreçtir. Burada ısısal olarak yalıtılmış bölmeli kabın bir tarafına belli bir hacimde gaz konur, kalan diğer tarafı ise boşaltılmıştır. Kabın ortasındaki engel kaldırılır ve bir taraftaki gaz tüm kaba yayılır.

Termodinamik'in üçüncü yasası bazen ‘mutlak sıfır sıcaklığında dengede olan sistemlerin özelliklerine ilişkin’ olarak şu şekilde tanımlanır:

Planck yasası belirli bir sıcaklıkta termal denge durumunda bulunan bir kara cisim ışımasının yaydığı elektromanyetik radyasyonu ifade eder. Yasa 1900 yılında Max Planck bu ismi önerdikten sonra isimlendirilmiştir. Planck yasası modern fiziğin ve kuantum teorisinin öncül bir sonucudur.
Fizikte, foton gazı, fotonların gaz benzeri birikmesidir ki hidrojen ve neon gibi sıradan gazlarla basınç, sıcaklık, entropi gibi benzer özelliklere sahiptir. Foton gazının dengedeki en yaygın örneği siyah cisim ışımasıdır.
Darcy yasası  , bir sıvının gözenekli bir ortamdan akışını tanımlayan bir denklemdir. Yasa, yer bilimlerinin bir kolu olan hidrojeolojinin temeldir. Kum yataklarından su akışı ile ilgili deneylerin sonucu.
, bir sıvının gözenekli bir ortamdan akışını tanımlayan bir denklemdir. Yasa, yer bilimlerinin bir kolu olan hidrojeolojinin temeldir. Kum yataklarından su akışı ile ilgili deneylerin sonucu.

İki izobarik yüzey arasındaki kalınlık, h tabakasının ortalama sanal sıcaklığına ilişkin bir denklemi verir.
Termodinamikte izovolümetrik süreç veya izometrik süreç olarak da adlandırılan izokorik süreç kapalı sistem hacminin sabit kalması demektir. İzokorik bir süreç, kapalı, elastik olmayan bir kabın içeriğinin ısıtılması veya soğutulması ile örneklendirilebilir. Kapalı sistem kabın içeriğinin dışarıya karşı izole olmasıdır. Kap deforme olmaz ve hacmi termodinamik süreç boyunca sabit kalırsa bu bir izokorik süreç örneğidir.
















