Cıva(II) fülminat
 | |
 | |
 | |
Diğer adlar Patlayıcı cıva, Dİoxycyanomercury | |
| Tanımlayıcılar | |
|---|---|
CAS numarası | |
3D model (JSmol) | |
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.010.053 |
PubChem CID | |
CompTox Bilgi Panosu (EPA) | |
| |
| |
| Özellikler | |
| Molekül formülü | C2N2O2Hg |
| Molekül kütlesi | 284.624 g/mol |
| Görünüm | Gri, Açık kahverengi veya Beyaz kristal katı |
| Yoğunluk | 4.42 g/cm3 |
| Erime noktası | 160°C |
| Kaynama noktası | 356.6°C |
| Çözünürlük (su içinde) | az çözünür |
| Çözünürlük | etanol ve amonyak’da çözünür |
| Tehlikeler | |
| İş sağlığı ve güvenliği (OHS/OSH): | |
| Ana tehlikeler | Çok Zehirli, Şoka Duyarlı Patlayıcı |
| NFPA 704 (yangın karosu) | |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |
Cıva(II) fülminat, Hg(CNO)2, primer patlayıcıdır. Sürtünme ve şoka çok duyarlı olduğundan dolayı özellikle diğer patlayıcıları patlatmak için kullanılan darbeli kapsüller ve patlatma kapsüllerinde bir tetikleyici olarak kullanılır.
İlk olarak 1830 yıllarından sonra küçük bakır kapsüller içerisinde bir ağızotu olarak kullanıldı. Cıva fülminat ağızdan dolma ateşli silahlarda karabarut dolumlarını ateşleme aracı olarak çakmak taşının hızla yerini aldı. Daha sonra, 19. yüzyıl sonları ve 20. yüzyılda, cıva fülminat ya da potasyum klorat tüfek ve tabanca mermilerindeki merkezi ateşlemeli kapsüllerde yaygın olarak kullanıldı. Korozif olmayan özelliği ile cıva fülminat, potasyum klorattan ayrı bir avantaj sağlasa da metal aksamı zayıflattığı bilinmektedir. Kapsüllerde kullanılan cıva fülminat günümüzde daha verimli kimyasal maddelerle yer değiştirmiştir. Kurşun azotür, kurşun stifnat ve tetrazen türevleri gibi bu maddeler zamanla korozif olmayıp, az zehirli ve daha kararlıdırlar. Ayrıca, savaş zamanında cıva gibi maddenin temin edilmesi güç olacağından dolayı Hg(II) fülminat'ın yerine geçen bu bileşiklerin hiçbirinin üretimi için cıvaya gereksinim duyulmaz.
Üretimi
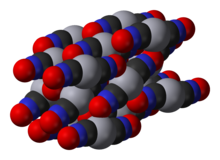
Cıva(II) fülminat nitrik asit içinde cıvanın çözündürülmesiyle elde edilen çözeltiye etanol katılmasıyla üretilir. İlk olarak, Edward Charles Howard tarafından 1800 yılında üretilmiştir.[1] Bu bileşiğin kristal yapısı ancak 2007 yılında belirlenmiştir.[2]
Gümüş fülminat da aynı yolla üretilebilir. Ancak, bu tuz cıva fülminattan daha da kararsızdır; su altında dahi patlayabilir ve kendi ağırlığının altında patladığı için büyük miktarlarda biriktirmenin imkânı yoktur.
Bozunma
Cıva(II) fülminatın termal bozunması 100 °C'den de az sıcaklıklarda başlayabilir, bozunma sıcaklığın artmasıyla çok daha yüksek bir oranda devam eder.[3]
Cıva(II) fülminatın bozumasına ait olası bir tepkime karbon dioksit gazı, azot gazı ve oldukça kararlı cıva tuzlarının bir birleşimini verir.
- 4 Hg(CNO)2 → 2 CO2 + N2 + HgO + 3 Hg(OCN)CN
- Hg(CNO)2 → 2 CO + N2 + Hg
- Hg(CNO)2 → Hg(OCN)2 (siyanat ve / veya izosiyanat)
- 2 Hg(CNO)2 → 2 CO2 + N2 + Hg + Hg(CN)2 (Cıva(II) siyanür)
Popüler kültürde tanınması
- AMC'de yayınlanan Breaking Bad dizi flminin, Sezon 1, Bölüm 6 "Crazy Handful of Nothin" adlı bölümünde, Walter White, Tuco Salamanca'nın mekanında yere bir parça cıva fülminat fırlatarak bir patlamaya neden olmaktadır. MythBusters adlı televizyon programının 12 Ağustos 2013 tarihinde yayınlanan bölümünde bu sahnedeki patlama etkisi incelenmiştir fakat deney beklenilen sonucu vermemiştir. Beklenilen etki için 250g gümüş fülminat ve cıva fülminat karışımı uzaktan patlatılmıştır ve tahtadan büyük bir kulübede dizideki gibi bir patlama etkisi gözlemlenmiştir.
Ayrıca bakınız
Yararlanılan kaynaklar
- ^ Edward Howard (1800). "On a New Fulminating Mercury". Philosophical Transactions of the Royal Society of London. 90 (1). ss. 204-238. doi:10.1098/rstl.1800.0012.
- ^ W. Beck, J. Evers, M. Göbel, G. Oehlinger and T. M. Klapötke (2007). "The Crystal and Molecular Structure of Mercury Fulminate (Knallquecksilber)". Zeitschrift für anorganische und allgemeine Chemie. 633 (9). ss. 1417-1422. doi:10.1002/zaac.200700176.
- ^ W. E. Garner & H. R. Hailes (1933). "Thermal decomposition and detonation of mercury fulminate". Proceedings of the Royal Society of London. 139 (1–3). ss. 1-40. Bibcode:1933CP....334..128S. doi:10.1098/rspa.1933.0040. 4 Mart 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Mart 2013.
Dış bağlantılar
- "300 years after discovery, structure of mercury fulminate finally determined". physorg.com. 24 Ağustos 2007. 6 Haziran 2011 tarihinde kaynağından arşivlendi. Erişim tarihi: 16 Kasım 2013.