Su, Dünya üzerinde bol miktarda bulunan ve tüm canlıların yaşaması için vazgeçilmez olan, kokusuz ve tatsız bir kimyasal bileşiktir. Sıklıkla renksiz olarak tanımlanmasına rağmen kızıl dalga boylarında ışığı hafifçe emmesi nedeniyle mavi bir renge sahiptir.

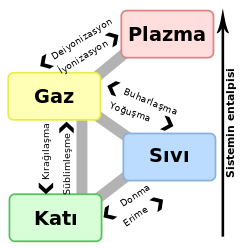
Bir fizik terimi olarak maddenin hâli, maddenin aldığı farklı fazlardır. Günlük hayatta maddenin dört farklı hâl aldığı görülür. Bunlar; katı, sıvı, gaz ve plazmadır. Maddenin başka hâlleri de bilinir. Örneğin; Bose-Einstein yoğunlaşması ve nötron-dejeneje maddesi. Fakat bu hâller olağanüstü durumlarda gerçekleşir, çok soğuk ya da çok yoğun maddelerde. Maddenin diğer hâllerininde, örneğin quark-gluon plazmalar, mümkün olduğuna inanılır fakat şu an sadece teorik olarak bilinir. Tarihsel olarak, maddenin özelliklerindeki niteleyici farklılıklara dayanarak ayrım yapılır. Katı hâldeki madde bileşen parçaları ile bir arada tutulur ve böylece sabit hacim ve şeklini korur. Sıvı hâldeki madde hacmini korur fakat bulunduğu kabın şeklini alır. Bu parçalar bir arada tutulur ama hareketleri serbesttir. Gaz hâlindeki madde ise hem hacim olarak hem de şekil olarak bulunduğu kaba ayak uydurur.Bu parçalar ne beraber ne de sabit bir yerde tutulur. Maddenin plazma hâli ise, nötr atomlarda dahil, hacim ve şekil olarak tutarsızdır. Serbestçe ilerleyen önemli sayıda iyon ve elektron içerirler. Plazma, evrende maddenin en yaygın şekilde görülen hâlidir.

Gaz, maddenin 4 temel hâlinden biridir. Bu haldeyken maddenin yoğunluğu çok az, akışkanlığı son derece fazladır. Gaz halindeki maddelerin belirli bir şekli ve hacmi yoktur. Katı bir madde ısıtıldığı zaman, katı halden sıvı, sıvı halden de gaz haline geçer. Bu duruma faz (safha) değişikliği denir. Sıvıyı meydana getiren tanecikler birbirlerini çeker. Sıvı ısıtıldığı zaman, tanecikler arasındaki çekim kuvveti yenilir ve tanecikler sıvı fazdan (ortamdan) ayrılarak gaz haline dönüşürler. Gazı meydana getiren tanecikler her yönde hareket edebilir ve bulundukları kabın hacmini alabilirler.

Sıcaklık ya da suhunet, bir cismin sıcaklığının ya da soğukluğunun bir ölçüsüdür. Gazlar için kinetik enerji, mutlak sıcaklık dereceleriyle orantılıdır.
- Duyularla algılanmakta ve genellikle sıcak ya da soğuk terimleri ile ifade edilmektedir. Teknik olarak bu değerlendirme doğru değildir. İki cisim birbirine temas ettirildiğinde sıcak olan soğumakta soğuk olan ısınmakta ve belirli bir süre temas halinde kaldıklarında her ikisi de aynı sıcaklığa gelmektedir. Buradan yola çıkarak; sıcaklık, bir maddenin ısıl durumunu belirten ve ısı geçişine neden olan etken olarak tanımlanabilir.
- Termik denge halinde bulunmayan sistemle çevresini termik denge haline getirmeye zorlayan potansiyeldir. Termik denge sağlandıktan sonra bu potansiyel kalkmakta, sistemde çevresiyle aynı değeri almaktadır.
- Noktasal bir özelliktir.
- Enerjinin mikroskobik düzeydeki statik hâlidir.
- Bir maddenin ortalama hıza sahip herhangi bir molekülünün kinetik enerjisiyle doğru orantılı olan büyüklüğüne denir.
- Sıcaklık, genleşmeye bakılarak dolaylı yoldan ölçülebilir. Ölçümünde, termometre denilen cihaz kullanılmaktadır.
- Bir cismin, etrafına, kendiliğinden enerji verme eğiliminin bir ölçüsüdür. Enerji veren madde daha yüksek sıcaklıktadır.

Hâl değişimi, bir maddenin moleküller arası potansiyel enerjisinin ısı alarak ya da vererek değişmesi sonucu meydana gelen olay.

Azot ya da nitrojen, simgesi N olan bir element olup atom numarası 7'dir. Renksiz, kokusuz, tatsız ve inert bir gazdır. Azot, dünya atmosferinin yaklaşık %78'ini oluşturur ve tüm canlı dokularında bulunur. Azot ayrıca, amino asit, amonyak, nitrik asit ve siyanür gibi önemli bileşikler de oluşturur.

Karbondioksit, kovalent bağlı bir karbon ve iki oksijen atomundan oluşan moleküle sahip, normal koşullarda gaz hâlinde bulunan bileşiğin adıdır. Renk ve kokusu yoktur. Kimyasal formülü CO2 şeklinde olup molekül ağırlığı 44,009 g/mol'dür. Karbon içeren besin maddelerinin metabolize edilmesi sonucu meydana gelen bir son üründür. Küresel ısınmada önemli bir pay sahibidir. Yerden yansıyan güneş ışınlarının atmosferden çıkma oranını azaltır.

Katı, maddenin atomları arasındaki boşluğun en az olduğu halidir. "Katı" olarak adlandırılan bu haldeki maddelerin kütlesi, hacmi ve şekli belirlidir. Bir dış etkiye maruz kalmadıkça değişmez. Sıvıların aksine katılar akışkan değildir. Fiziksel yollarla, diğer üç hal olan sıvı, gaz ve plazmaya dönüştürülebilirler. Altın demir gibi madenler katı maddelere örnektir. Ayrıca katı maddeler atomlarının en yavaş hareket edebildiği haldir. Doğa'da amorf veya kristal yapıda bulunurlar. Amorf katılar maddenin taneciklerinin düzensiz olma durumudur. Kristal katılar ise de maddenin taneciklerinin düzenli olma durumudur. Kristal katılar da aralarında 4'e ayrılır.

Klima, elektrikli klima veya pasif soğutma ve havalandırmalı soğutma dâhil olmak üzere çeşitli diğer yöntemlerin kullanımıyla daha konforlu bir iç ortam elde etmek için kapalı bir alandaki havanın ısı ve nem kontrol edilmesi işlemidir. Klima, "ısıtma, havalandırma ve klima" (HVAC) sağlayan sistem ve teknikler ailesinin bir üyesidir.
Buğu, istim veya islim ; fizik, kimya ve mühendislikte, buharlaşmış suyu ifade eder. 100 santigrat derece civarındaki sıcaklıkta ve standart atmosferik basınçtaki buhar, saftır, saydam gaz haldedir ve sıvı haldeki sudan 1600 kat daha hacimlidir. Buhar doğal olarak suyun kaynama noktasından daha sıcaktır. Daha yüksek sıcaklıklardaki buhara genelde kızdırılmış buhar denir.

Su buharı, normal şartlar altında sıvı hâlde bulunan suyun gaz hâlidir. Su, her sıcaklıkta buharlaşabildiği için havada her zaman su buharı bulunur. Buharlaşma su yüzeyinden meydana gelir. Suyun su buharı hâline gelmesine buharlaşma denir. Su buharının tekrar su hâline geçmesine de yoğunlaşma denir. Atmosferde bulunan su buharı ani yoğunlaşmalar yaşarsa yağmur yağar, yoğunlaşma ortamı aniden ve aşırı soğursa su buharı direkt yoğunlaşma olmadan katı hâle geçer. Buna da kırağılaşma denir.
- Buharlaşma, bir hâl değişimidir. Sıvıların ısı alarak gaz hâline geçmesidir.
- Kolonya kokusunun odaya yayılması (difüzyon),
- Bulutların oluşması, buharlaşmaya en iyi örnektir.
- Buharlaşma her sıcaklıkta olabilir.
- Sıcaklık arttığında maddelerde genleşme olur.
- Su buharı suyun en düzensiz hâlidir. Bu hâlde su moleküllerinin hızı en fazladır.
Soğutucu akışkanlar, klima sistemlerinin ve ısı pompalarının soğutma döngüsünde kullanılan ve çoğu durumda sıvıdan gaza tekrarlanan bir faz geçişine ve tekrar geri dönen maddelerdir. Sıcaklığa ve basınca bağlı olarak saf olabilir veya sıvı veya gaz fazında veya her ikisinde bulunan saf sıvıların bir karışımı olabilir. Akışkan, düşük sıcaklık ve düşük basınçta ısıyı emer ve daha sonra, genellikle hâl değişikliği ile daha yüksek sıcaklık ve basınçta ısı verir.
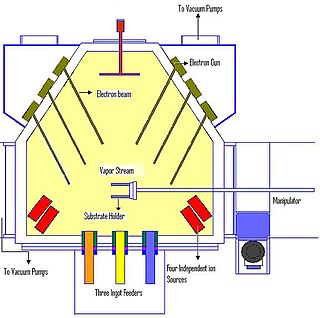
Elektron demeti ile fiziksel buhar biriktirme işlemi, anottaki hedef malzemenin, çok yüksek vakum altında, tungsten bir flaman ile elektron bombardımanına tutulması ile gerçekleştirilir. Elektron demeti, hedefteki atomların yüzeyden koparak gaz fazına geçmesini sağlar. Buharlaştırılan bu atomlar, vakum çemberi içindeki her noktaya yapışarak ince bir film oluşmasını sağlarlar.

Su döngüsü yahut hidrolojik döngü, suyun Dünya yüzeyinin üstünde ve altında sürekli hareketini tanımlar. Suyun okyanus ile denizlerden atmosfere, atmosferden yeryüzüne ve yeniden deniz-okyanuslara ulaşması şeklindeki genel turu, döngüyü oluşturur. Evrenin korunumu yasası gibi, yeryüzündeki su kaynaklarının artmaz veya eksilmezliğini ifade eden bir terimdir ve bir başlangıç veya sonu yoktur.

Roket motoru, genellikle yüksek sıcaklıktaki gaz olan yüksek hızlı itici bir sıvı jeti oluşturmak için tepkime kütlesi olarak depolanmış roket itici gazlarını kullanır. Roket motorları, Newton'un üçüncü yasasına göre kütleyi geriye doğru fırlatarak itme üreten tepki motorlarıdır. Çoğu roket motoru, gerekli enerjiyi sağlamak için reaktif kimyasalların yanmasını kullanır, ancak soğuk gaz iticileri ve nükleer termal roketler gibi yanmayan biçimleri de mevcuttur. Roket motorları tarafından tahrik edilen araçlara genellikle roket denir. Roket araçları, çoğu yanmalı motorun aksine kendi yükseltgen taşır, bu nedenle roket motorları, uzay aracını ve balistik füzeleri itmek için bir boşlukta kullanılabilir.

Yoğunlaşma veya yoğuşma, maddenin fiziksel halinin gaz fazından sıvı faza değişimi ve buharlaşmanın tersidir. En sık su döngüsü anlamında kullanılır. Atmosfer içinde bir sıvı veya katı bir yüzey veya Yoğunlaşma bulutu ile temas ettiğinde, su buharının sıvı suya değişmesi olarak da tanımlanabilir. Doğrudan gaz fazdan katı faza geçiş gerçekleştiğinde, değişime kırağılaşma denir.

Fiziksel bilimlerde faz; bir malzemenin fiziksel özelliklerinin her noktasında aynı olduğu bölgedir/alandır. Fiziksel özelliklerinin örneklerinden üç tanesi, yoğunluk içermesi, mıknatıslanma ve kimyasal bileşimi indeksi. Basit bir açıklama ile bir faz fiziksel olarak ayrı, kimyasal olarak yeknesak ve (genellikle) mekanik ayrılabilir malzemeli bir bölge olmasıdır. Bir cam kavanoz buz ve sudan oluşan bir sistemde, buz küpleri birinci faz, su ikinci faz ve suyun üstünde bulunan nem ise üçüncü fazdır. Cam kavanoz ise başka bir ayrı aşamasıdır. Faz terimi bazen maddenin hali olarak eş anlamlı bir şekilde kullanılabilir. Ancak bir maddenin aynı halde çok sayıda karışmayan fazı olabilir. Ayrıca, faz terimi bazen bir faz diyagramı için üzerinde sınır ile basınç ve sıcaklık gibi durum değişkenler açısından sınırı çizilmiş denge durumunda bir dizi oluşturmak için kullanılır. Faz sınırları gibi katı veya başka bir kristal yapısından daha ince değişikliğine sıvıdan bir değişiklik olarak maddenin organizasyon değişiklikleriyle ilgili olduğundan bu son kullanım durumuna eş anlamlısı olarak "faz" kullanımına benzer. Ancak, madde ve faz diyagramı kullanımların hali yukarıda verilen ve amaçlanan anlam terim kullanıldığı bağlamdan kısmen tespit edilmelidir resmi tanımı ile orantılı değildir. Fazın çeşitleri Farklı fazlar, gaz, sıvı, katı, plazma veya Bose-Einstein yoğuşma ürünü olarak maddenin farklı durumlar olarak tarif edilebilir. Maddenin katı ve sıvı formda diğer haller arasındaki faydalı mezofazlar.

Trouton yasası çoğu sıvının kaynama noktası sırasındaki buharlaşma entropisinin yaklaşık 85-88 J K−1 mol−1, olduğunu söyler Bu buharlaşma entropisi buharlaşma entalpisinin kaynama sıcaklığına oranıdır. Yasa ismini Frederick Thomas Trouton'dan almıştır.

Kimyada, uçuculuk bir maddenin ne kolaylıkta buharlaştığını tanımlayan bir özelliktir. Belirli bir sıcaklık ve basınçta, yüksek uçuculuğa sahip bir maddenin buhar olarak bulunma olasılığı daha yüksekken, düşük uçuculuğa sahip bir maddenin sıvı ya da katı olma olasılığı daha yüksektir. Uçuculuk, bir buharın sıvı veya katı hâline yoğunlaşma eğilimini de tarif edebilir; daha az uçucu madde, yüksek uçucu maddelere göre buhardan daha kolay yoğunlaşacaktır. Uçuculuktaki farklılıklar, bir madde grubunun atmosfere açık olduğunda ne kadar hızlı buharlaştığını karşılaştırarak görülebilir. İspirto gibi yüksek derecede uçucu bir madde hızlı bir şekilde buharlaşırken, bitkisel yağ gibi düşük uçuculuğa sahip bir madde yoğuşmuş kalacaktır. Genel olarak, katılar sıvılardan daha az uçucudur, ancak bazı istisnalar da vardır. Kuru buz veya iyot gibi süblimleşen katı maddeler standart koşullar altında bazı sıvılarla aynı oranda buharlaşabilir.
Reaksiyon kinetiği olarak da bilinen kimyasal kinetik, kimyasal reaksiyonların hızlarını ve mekanizmalarını araştırmakla ilgilenen bir fiziksel kimya dalıdır. Bir sürecin gerçekleştiği yön ile ilgilenen ancak gerçekleşme hızları hakkında bir bilgi vermeyen termodinamik ile karıştırılmamalıdır. Kimyasal kinetik, deneysel koşulların kimyasal reaksiyonların hızı üzerine etkilerini, reaksiyon mekanizmaları ile geçiş hâllerinin verim bilgilerini ve kimyasal reaksiyonların karakteristiklerini tanımlayan matematiksel modellerin çıkarılmasını kapsayan bir bilim alanıdır.