Bromöz asit
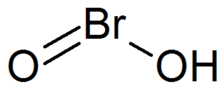 | |
 | |
 | |
| Adlandırmalar | |
|---|---|
bromöz asit | |
| Tanımlayıcılar | |
3D model (JSmol) | |
| ChEBI | |
| ChemSpider | |
PubChem CID | |
CompTox Bilgi Panosu (EPA) | |
| |
| Özellikler | |
| Molekül formülü | HBrO2 |
| Molekül kütlesi | 112.911 g/mol |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |
Bromöz asit, HBrO2 formülüne sahip bir inorganik bileşiktir. Konjugat bazının -bromitlerinin- tuzları izole edilmiş olmasına rağmen, kararsız bir bileşiktir. Asidik çözeltide, bromitler broma ayrışır.[1]
Keşif
1905 yılında Richards A.H., gümüş nitrat (AgNO3) ve brom içeren bir dizi deney yoluyla broş asit varlığını kanıtladı.[2] Aşırı soğuk sulu reaksiyonun, hipobromöz asit (HBrO), gümüş bromür (AgBr) ve nitrik asit (HNO3) oluşturmak için reaksiyonu:
- Br2 + AgNO3 + H2O → HBrO + AgBr + HNO3
Richards, konsantre bir gümüş nitratta (AgNO3) fazla sıvı brom ilave edilmesinin etkisinin farklı bir reaksiyon mekanizmasıyla sonuçlandığını keşfetti. Önceki reaksiyondan oluşturulan asit brom eşdeğer kısımlarının sayısından, oksijen ve brom arasındaki oran, O:Br (0.149975:0.3745) tam değeri ile hesaplandı, bu da asit bileşiğinin bir brom atomuna iki oksijen atomu içerdiğini düşündürüyor. Böylece, asit bileşiğinin kimyasal yapısı HBrO2 olarak çıkarıldı.[2]
Richards'a göre, hipobromöz asit (HBrO), brom ve gümüş nitrat çözeltisinin reaksiyonu ile ortaya çıkar:[2]
- Br2 + AgNO3 + H2O → HBrO + AgBr + HNO3
- 2 AgNO3 + HBrO + Br2 + H2O → HBrO2 + 2 AgBr
İsomerizm
HBrO2 molekülü 106.1o ∠(H−O−Br) açılarına sahip bükülmüş bir yapıya sahiptir. HOBrO ayrıca 74.2o'lik bir dihedral açı ∠(H−O−Br−O) benimseyen bir izomer yapısı (2a) ile düzlemsel olmayan bir konformasyon benimser. Ayrıca, diğer iki izomerin (2b-cis ve 2c-trans) düzlemsel yapıları hızlı enantiyomerizasyon için geçiş durumudur.[3]
Başka bir çalışmada üç izomer tanımlanmıştır: HOOBr, HOBrO ve HBr(O)O.[4]
Sentezi
Bromöz asit (HBrO2) ve hidroklorik asit (HCl) üretmek için hipobromöz asit (HBrO) ve hipokloröz asit (HCIO) arasında bir oksidasyon reaksiyonu kullanılabilir.[5]
- HBrO + HClO → HBrO2 + HCl
Hipobromöz asidin (HBrO) bir redoks reaksiyonu, ürünü olarak bromöz asit (HBrO2) oluşturabilir:[5]
- HBrO + H2O - 2e− → HBrO2 + 2H+
İki eşdeğeri hipobromöz asidin (HBrO) orantısız reaksiyonu, hem bromöz asit (HBrO2) hem de hidrobromik asit (HBr) oluşumuyla sonuçlanır:[5]
- 2 HBrO → HBrO2 + HBr
Bromik asit (HBrO3) ve hidrobromik asit (HBr) senkron-oranından kaynaklanan bir yeniden düzenleme reaksiyonu, bromöz asit (HBrO2) verir:[5]
- 2 HBrO3 + HBr → 3 HBrO2
Sodyum bromit
NaBrO2·3H2O ve Ba(BrO2)2·H2O tuzları kristalleştirildi. Bu sulu çözeltilerin Pb2+, Hg2+ ve Ag+ tuzları ile işlenmesi üzerine, karşılık gelen ağır metal bromitler katı madde olarak çökelir.[1]
Belousov–Zhabotinsky reaksiyonu
Bromöz asit, seyreltik sülfürik asit içindeki potasyum bromat, seryum(IV) sülfat, propandioik asit ve sitrik asit kombinasyonundan kaynaklanan Belousov-Zhabotinsky reaksiyonunun bir ürünüdür. Bromöz asit, bromat iyonu (BrO−3) ve bromür (Br−) arasındaki reaksiyonun bir ara aşamasıdır:[6][7]
- BrO−3 + 2 Br− → HBrO2 + HBrO
Bu salınım reaksiyonlarındaki diğer ilgili reaksiyonlar şunlardır:
- HBrO2 + BrO−3 + H+ → 2 BrO•2 + H2O
- 2 HBrO2 → BrO−3 + HOBr + H+
Bromitler permanganatları manganatlara(VI) azaltır:[1]
- 2 MnO−4 + BrO−2 + OH− → 2 MnO2−4+ BrO−3 + H2O
pKa ölçümü
Bromöz asidin asit ayrılma sabiti, Ka = [H+][BrO-2][HBrO2], farklı yöntemler kullanılarak belirlenmiştir.
Bromöz asidin pKa değerinin bromiterin ayrışmasını inceleyen araştırmalarda tahmin edildi. Araştırma, hidrojen ve bromit iyon konsantrasyonlarının bir fonksiyonu olarak bromit ayrışma oranını ölçtü. İlk hız günlüğünün deneysel verileri pH'a karşı çizilmiştir. Bu yöntemi kullanarak, bromöz asit için tahmini pKa değeri 6.25'tir.[8]
Başka bir yöntem kullanılarak, bromöz asit için pKa, sodyum bromitler ve potasyum iyodür arasındaki reaksiyonun başlangıç hızına dayanarak, 25 °C'de 2.9–8.0 ve 0.06 M iyonik mukavemetli bir pH aralığında ölçülmüştür. Bu orantısız reaksiyonun başlangıç hızının 4.5-8.0 pH aralığında [H+] üzerindeki birinci dereceden bağımlılığı. Bu yöntemle ölçülen asit ayrılma sabiti değeri Ka = (3.7±0.9)×10−4 M ve pKa = 3.43±0.05.[9]
Reaktivite
Diğer oksijen merkezli oksidanlar (hipohalitler, peroksit anyonları) ile karşılaştırıldığında ve düşük bazikliğine uygun olarak bromit oldukça zayıf bir nükleofildir.[10] Bromürün karbokasyonlara ve alıcı ile ikame edilmiş olefinlere karşı oran sabitleri, hipobromit ile ölçülenlerden 1-3 kat daha düşüktür.
Kaynakça
- ^ a b c Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier ISBN 0-12-352651-5
- ^ a b c "Journal of the Society of Chemical Industry. v.25 1906" 4 Temmuz 2020 tarihinde Wayback Machine sitesinde arşivlendi.. HathiTrust. Retrieved 2017-04-28.
- ^ Glaser, Rainer; Jost, Mary (2012-08-16). "Disproportionation of bromous acid HOBrO by direct O-transfer and via anhydrides O(BrO)2 and BrO-BrO2. An ab initio study of the mechanism of a key step of the Belousov–Zhabotinsky oscillating reaction". The Journal of Physical Chemistry A. 116 (32): 8352–8365. doi:10.1021/jp301329g. ISSN 1520-5215. PMID 22871057 30 Ocak 2020 tarihinde Wayback Machine sitesinde arşivlendi..
- ^ Souza, Gabriel L. C. de; Brown, Alex (2016-07-01). "The ground and excited states of HBrO2 [HOOBr, HOBrO, and HBr(O)O] and HBrO3 (HOOOBr and HOOBrO) isomers". Theoretical Chemistry Accounts. 135 (7): 178. doi:10.1007/s00214-016-1931-8. ISSN 1432-881X.
- ^ a b c d C., Ropp, R. (2013-01-01). Encyclopedia of the alkaline earth compounds. Elsevier. ISBN 9780444595508. OCLC 964753424.
- ^ Vassalini, Irene; Alessandri, Ivano (2015). "Spatial and Temporal Control of Information Storage in Cellulose by Chemically Activated Oscillations". ACS Applied Materials & Interfaces. 7 (51): 28708–28713. doi:10.1021/acsami.5b11857. PMID 26654462 30 Ocak 2020 tarihinde Wayback Machine sitesinde arşivlendi..
- ^ Field, Richard J.; Koros, Endre; Noyes, Richard M. (1972-12-01). "Oscillations in chemical systems. II. Thorough analysis of temporal oscillation in the bromate-cerium-malonic acid system". Journal of the American Chemical Society. 94 (25): 8649–8664. doi:10.1021/ja00780a001. ISSN 0002-7863.
- ^ Massagli, A. (1970-01-01). "Kinetic investigation of the decomposition of bromite - ScienceDirect". Inorganica Chimica Acta. 4: 593–596. doi:10.1016/S0020-1693(00)93357-7.
- ^ Faria, R. B.; Epstein, Irving R.; Kustin, Kenneth (1994-01-01). "Kinetics of Disproportionation and pKa of Bromous Acid". The Journal of Physical Chemistry. 98 (4): 1363–1367. doi:10.1021/j100055a051. ISSN 0022-3654.
- ^ Mayer, Robert J.; Ofial, Armin R. (2018-02-22). "Nucleophilic Reactivities of Bleach Reagents". Organic Letters. 20 (10): 2816–2820. doi:10.1021/acs.orglett.8b00645. PMID 29741385 30 Ocak 2020 tarihinde Wayback Machine sitesinde arşivlendi..