Kimya, maddenin yapısını, özelliklerini, birleşimlerini, etkileşimlerini, tepkimelerini araştıran ve uygulayan bilim dalıdır. Kimya bilmi daha kapsamlı bir ifadeyle maddelerin özellikleriyle, sınıflandırılmasıyla, atomlarla, atom teorisiyle, kimyasal bileşiklerle, kimyasal tepkimelerle, maddenin hâlleriyle, moleküller arası ve moleküler kuvvetlerle, kimyasal bağlarla, tepkime kinetiğiyle, kimyasal dengenin prensipleriyle vb konularla ilgilenir. Kimyanın en önemli dalları arasında analitik kimya, anorganik kimya, organik kimya, fizikokimya ve biyokimya sayılır.

Tuz, kimyada, bir asitle bir bazın tepkimeye girmesi neticesinde meydana gelen maddedir. Tuz, asitteki eksi yüklü iyonla (anyon) bazdaki artı yüklü iyondan (katyon) meydana gelir. Asitle baz arasındaki nötralleşme tepkimesi esnasında tuz ve su açığa çıkar. Erimiş tuz veya çözelti halindeki tuzların çoğu eksi ile artı yüklü iyonlarına ayrışır ve elektriği iletir. Tuz adı ayrıca sofra tuzu veya sodyum klorür (NaCl) için de kullanılır.
Hidroliz işlemi suyu oluşturan hidrojen ve oksijen elementlerinin birbirinden ayrılması ile sonuçlanan bir işlemdir. Bazı kaynaklarda hidroliz, moleküllerin su ilavesiyle daha fazla sayıda parçacık oluşturması olarak da geçer. Hidroliz, su ile bir kimyasal bağın parçalanmasıdır yani bir kimyasal reaksiyondur. Hidroliz genel olarak suyun nükleofil olduğu ikame(yer değiştirme reaksiyonu), eliminasyon(organik reaksiyon türü) ve solvasyon (çözme) reaksiyonları için kullanılır.
Baz, suda iyonlaştıklarında ortama OH− (hidroksit) iyonu ve elektron çifti verebilen maddelerdir. Bazlar da, asitler gibi tehlikeli maddelerdir. Suda iyonlaştıklarında hidroksit (OH−) iyonu derişimini arttıran maddelere baz denir. Bilinen en güçlü baz Sezyum hidroksittir (CsOH).

Karboksilik asitler karboksil grubu olan organik asitlerdir, -C(=O)OH formülüne sahiptirler, bu genelde -COOH veya CO2H olarak da yazılır. Karboksilik asitler Bronsted asitleridir, yani proton vericileridir. Karboksilik asitlerin tuz ve anyonlarına karboksilat denir. Karboksilik asitler, esterlerle fonsiyonel grup izomeridirler. Karboksilik asitlerin en basit dizisi alkanoik asitlerdir, R-COOH formülüyle gösterilirler, R bir hidrojen atomu veya bir alkil grubuna karşılık gelir. Bileşiklerde birden fazla karboksilik asit grubu bulunabilir.

Kimyada esterler, bir hidroksil grubundaki hidrojen atomunun bir organik grup (bu metinde R' olarak gösterilecektir) ile yer değiştirmiş olduğu organik bileşiklerdir. Hidrojenin bir H+ iyonu olarak ayrışabileceği -OH grubu olan bu tür asitlere oksijen asidi denir.

Kimyada amid sözcüğü iki anlama sahiptir: - Birinci anlamıyla amid, bir azot atomuna (N) bağlı bir karbonil grubu bulunduran bir organik fonksiyonel grup veya bu gruba sahip bir bileşiktir. - İkinci anlamıyla amid, bir azot anyonudur.
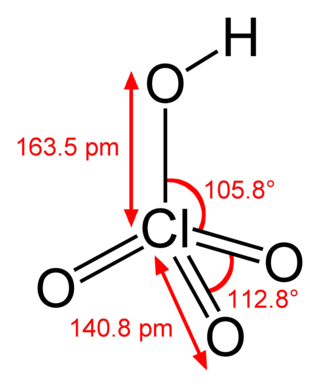
Perklorik asit, HClO4, suda çözünebilen renksiz bir sıvı olan bir klor oksoasididir. Sülfürik asit ya da nitrik asit ile kıyaslanabilecek kadar güçlü bir asittir. Perklorik asit bir süper asittir ancak en güçlü Brønsted-Lowry asidi değildir (en güçlüsü HSbF6 ya da floroantimonik asittir). Asidin pKa'sı −7'dir.
Hidronyum (H3O) ;IUPAC'te adlandırılması oksonyum şeklindedir. Bir molekülünde 3 hidrojen ve 1 oksijen atomu bulunur. Hidronyum iyonu, (H3O) asitler suda çözündüklerinde açığa çıkan katyondur. Aynı zamanda asitleri bazlardan ayırmada kullanılır. (Brønsted-Lowry asit-baz teorisi)Bir asit suda çözündüğü zaman hidronyum katyonu ortaya çıkar. Bazı asit çözünme tepkimelerinde kolaylık olması amacıyla (H+) iyonu şeklinde de gösterilse de doğru kullanımı (H3O) şeklindedir. pH'ın belirlemesinde kullanılır. Eğer çözünen maddenin [H+] konsantrasyonu ile [OH-] eşitse o madde nötrdür.
Kimyasal reaktiflik, bir reaksiyonun meydana gelme eğilimiyle ilişkilidir. Kimyasal tepkimelerin gerçekleşmesini belirleyen faktörler termodinamik düzeyinde incelenir. Termodinamik olarak bir reaksiyon eğer tepkimenin ürünleri reaktanlara kıyasla daha düşük serbest enerji düzeyinde ise gerçekleşir. Diğer taraftan Reaktiflik ise genel olarak bir maddenin kimyasal değişikliklere ya da kimyasal tepkimelere girme eğilimine denir. Elementlerin atomik yapısı ve elektronlarının dizilişi elementlerin ve oluşturdukları moleküllerin reaktifliğinde önemli rol oynar. Soygazların örneğin kimyasal olarak çok az reaktiflik gösterdiği belirtilir. Dolayısıyla kimyasal bileşik oluşturmaları zordur. Bu durum soygazların tam dolu olan en dış elektron kabuğundan dolayıdır.
Kimyasal denge, asit ve baz kimyası, elektron aktarımı tepkimesi ve entropi gibi konular kimyasal reaktifliğin temel kavramlarıdır.
Bir asidin kuvveti, onun içinde bulunduğu çözeltiye ne kadar proton (H+) verebildiğinin ölçüsüdür. Kuvvetli asitler %100 çözünürler ve bu çözünme iyonlaşarak gerçekleşir. Yani 1 mol HA kuvvetli asidi suda çözündüğünde 1 mol H+ ve onun eşlenik bazı A- 1 mol oluşur. Hidroklorik asit, hidroiyodik asit, hidrobromik asit, perklorik asit, nitrik asit ve sülfürik asit, kuvvetli asitlere örnektir.
Konjuge asit, Brønsted–Lowry asit–baz kuramında, bir bazın proton alışı (H+) ile oluşan tür.Konjuge baz ise asit proton verdikten sonra oluşan türdür.

Johannes Nicolaus Brønsted, Danimarkalı fiziksel kimyacıdır. 1899'da kimya mühendisliği diploması ve doktorasını kazandı. 1908'de Kopenhag Üniversitesi'nden ve hemen ardından aynı üniversitede inorganik ve fiziksel kimya profesörü olarak atandı.
Lewis asiti Lewis bazıyla Lewis eklenme ürününü oluşturmak için etkileşen kimyasal türdür. Lewis bazı, Lewis eklenme ürününü oluşturmak için, Lewis asidine elektron çifti veren türdür. Örneğin, OH− ve NH3 Lewis bazlarıdır çünkü bu iyonlar bağ yapmamamış elektron çiftlerini verebilirler. Eklenme ürününde, Lewis asidi ve bazı Lewis bazından gelen elektron çiftini paylaşır. Lewis asit ve bazının isim babası Gilbert N. Lewis'dir.
Deprotonasyon bir asit-tepkimesinde bir Brønsted–Lowry asitinden bir protonun ayrılması sürecidir. Oluşan ürün bahsi geçen asitin konjuge bazıdır. Tamamlayıcı süreci ise protonasyon olarak adlandırılır. Bu süreçten çıkan ürün türü ise bazın konjuge asitidir.
Asit-baz tepkimesi, bir asit ile bir baz arasında meydana gelen kimyasal tepkimedir. Tepkime mekanizmalarının açıklanması ve bu mekanizmalar kullanılarak ilgili problemlerin çözülmesi amacıyla bu tür tepkimelere dair teoriler geliştirilmiştir; bunların önde gelenleri arasında Brønsted-Lowry asit-baz kuramı bulunur. Bu konudaki ilk teori 1776 yılında Fransız kimyager Antoine Lavoisier tarafından geliştirildi.
Kimya ve biyokimyada ayrışma, moleküllerin (veya tuzlar veya bileşikler gibi iyonik bileşiklerin) atomlar, iyonlar veya radikaller gibi daha küçük parçacıklara ayrıldığı genel bir süreçtir. Örneğin, bir asit suda çözündüğünde, bir elektronegatif atom ile bir hidrojen atomu arasındaki kovalent bir bağ, bir proton (H+) ve bir negatif iyon veren heterolitik fisyon tarafından kırılır. Ayrışma, birleşme veya rekombinasyonun tersidir.
Lobry de Bruyn-Alberda van Ekenstein dönüşümü, Karbonhidrat kimyasında olarak da bilinen Lobry de Bruyn-Van Ekenstein dönüşümü, reaksiyon ara maddesi olarak tautomerik bir enediol ile bir aldozun ketoz izomerine veya tam tersine baz veya asit katalizli dönüşümüdür.
Kimyada, süper asit, orijinal tanımıyla, asitliği %100 saf sülfürik asitten daha yüksek olan bir asittir. Modern tanımıyla süper asit, protonun kimyasal potansiyelinin saf sülfürik asitten daha yüksek olduğu bir ortamdır. Ticarî olarak temin edilebilen süperasitler arasında triflik asit olarak da bilinen triflorometansülfonik asit ve florosülfürik asit bulunur; bunların her ikisi de sülfürik asitten yaklaşık bin kat daha güçlüdür, yani daha negatif H0 değerlerine sahiptir.

Sulu çözelti, çözücünün su olduğu bir çözeltidir. Çoğunlukla kimyasal denklemlerde ilgili kimyasal formüle (aq) eklenerek gösterilir. Örneğin, sodyum klorür (NaCl) olarak da bilinen sofra tuzunun sudaki çözeltisi Na+(aq) + Cl-(aq) şeklinde gösterilir. Aqueous kelimesi (aqua'dan gelir) suya ait, su ile ilgili, suya benzer veya suda çözünmüş anlamına gelir. Su mükemmel bir çözücü olduğundan ve aynı zamanda doğal olarak bol bulunduğundan, kimyada her yerde bulunan bir çözücüdür. Deneylerde çözücü olarak sıklıkla su kullanıldığından, çözücü belirtilmediği sürece çözelti kelimesi sulu bir çözeltiyi ifade eder.

 eşlenik baz + eşlenik asit.
eşlenik baz + eşlenik asit.





