
Termodinamik; ısı, iş, sıcaklık ve enerji arasındaki ilişki ile ilgilenen bilim dalıdır. Basit bir ifadeyle termodinamik, enerjinin bir yerden başka bir yere ve bir biçimden başka bir biçime transferi ile ilgilenir. Bu süreçteki anahtar kavram, ısının, belirli bir mekanik işe denk gelen bir enerji biçimi olmasıdır.

İdeal gaz yasası, sadece teoride olan ideal gazların durumları hakkında denklemler sağlayan bir yasadır. Bir miktar gazın durumu; basıncı, hacmi ve sıcaklığına göre belli olur. Bu denklem aşağıdaki gibidir:

- P paskal olarak basınç,
- V kübik metre olarak hacim,
- n gazın mol sayısı,
- R gaz sabiti
- T Kelvin olarak sıcaklık

Genleşme, sıcaklığı artırılan bir cismin uzunluk ya da hacminin değişmesi olayıdır.

Gaz yasaları, gazlardaki termodinamik sıcaklık (T), basınç (P) ve hacim (V) aralarındaki ilişkileri açıklayan bir takım kanundur. Rönesans'ın geç dönemleriyle 19. yüzyıl arasındaki dönemde bulunmuş birkaç yasadan oluşur.
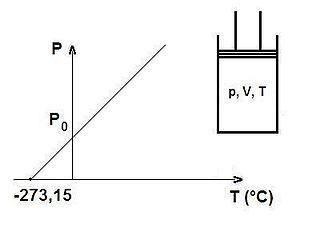
Charles yasası, gaz yasalarından biridir. Bu yasaya göre, sabit basınçta, herhangi bir miktardaki ideal gazın hacminin azalıp çoğalması, aynı oranda sıcaklığının da azalıp çoğalmasını etkiler.

Gay-Lussac yasası, Fransız kimyacı Joseph Louis Gay-Lussac'ın adıyla anılır. Gay-Lussac'a mal edilen, iki tane gaz yasası vardır. İkisi de aynı isimle anılırlar. En ünlü deneyi gazlarla yaptığı sıcaklık değişiminin inciler üzerindeki basınç değişimini dedesi Mark Lussac ile yapmıştır.
Avogadro yasası ya da Avogadro hipotezi, Amedeo Avogadro'nun 1811'de bulduğu bir gaz yasasıdır. Bu yasa, eşit hacimdeki gazların; eşit sıcaklık ve eşit basınçta aynı sayıda parçacık ya da molekül sayısına sahip olduğunu öne sürer. Buna göre, belirli bir hacimdeki gazın bulundurduğu molekül sayısı, gazın kütle ya da boyutundan bağımsızdır. Örnek olarak, aynı hacimdeki hidrojen ve nitrojen verilebilir. Buna göre, hidrojen de nitrojen de, aynı hacim, aynı basınç ve aynı sıcaklıkta aynı molekül sayısına sahiptir.
Kinetik teori veya gazların kinetik teorisi, gazların basınç, sıcaklık, hacim gibi makroskobik özelliklerini moleküler bileşim ve hareketlerine bağlı olarak açıklayan teoridir. Esas olarak, teori Isaac Newton'un kanısının tersine basıncın moleküller arası statik itmeden kaynaklanmadığını, bunun yerine belli hızlarda hareket eden moleküller arası çarpışmalardan kaynaklandığını söyler. Kinetik teori aynı zamanda kinetik-moleküler teori veya çarpışma teorisi olarak da bilinir.

Klasik istatistik fizikte eşbölüşüm teoremi bir sistemin ortalama enerjisi ile sıcaklığı arasında ilişki kuran genel bir teoremdir. Eşbölüşüm teoremi ayrıca eşbölüşüm yasası, enerjinin eşbölüşümü veya basitçe eşbölüşüm olarak da bilinir. Eşbölüşümün temel düşüncesi, termal dengede enerjinin çeşitli formları arasında eşit olarak paylaşılmasıdır; örneğin bir molekülün öteleme hareketindeki ortalama kinetik enerjisi dönme hareketindeki ortalama kinetik enerjiye eşit olmalıdır.

Ludwig Eduard Boltzmann. Avusturyalı fizikçi. İstatistiksel mekanik ve istatistiksel termodinamik alanındaki buluşları ve katkıları ile ünlüdür. Henüz tartışmalı olduğu günlerde dahi atom teorisinin en önemli savunucuları arasında yer almıştır.
Knudsen sayısı, moleküler ortalama serbest yol ile kabaca ölçülebilir uzunluk skalasının oranını veren boyutsuz sayıdır. Bu uzunluk skalası, örneğin, bir sıvının içinde yer alan bir cismin çapı olabilir. Knudsen sayısı adını Danimarkalı fizikçi Martin Knudsen'e (1871-1949) atfen almıştır.
Termal enerji, ortam veya sistem sıcaklığı sonucunda ortamdaki veya sistemdeki bir cismin veya maddenin potansiyel ve kinetik enerjileri toplamını ifade eden bir enerji biçimidir. Sistemde sıcaklık olmadığı müddetçe bu niceliği tanımlamak zor ve hatta anlamsız olabilir. Bu durumda herhangi bir termal iş söz konusu değildir.

Dalton yasası, bir gaz karışımının toplam basıncının, karışımı oluşturan gazların kısmi basınçlarının toplamına eşit olduğunu açıklayan bir fiziksel kimya yasasıdır. Bu ampirik yasa John Dalton tarafından 1801 yılında deneysel olarak gözlemlenmiş ve 1802 yılında yayımlanmıştır. Dalton yasası ideal gaz kanunlarıyla ilgilidir.

Joule genişlemesi termodinamikte (ısıdevinimsel) geri dönülmez (tersinemez) bir süreçtir. Burada ısısal olarak yalıtılmış bölmeli kabın bir tarafına belli bir hacimde gaz konur, kalan diğer tarafı ise boşaltılmıştır. Kabın ortasındaki engel kaldırılır ve bir taraftaki gaz tüm kaba yayılır.
Fizikte, foton gazı, fotonların gaz benzeri birikmesidir ki hidrojen ve neon gibi sıradan gazlarla basınç, sıcaklık, entropi gibi benzer özelliklere sahiptir. Foton gazının dengedeki en yaygın örneği siyah cisim ışımasıdır.

Trouton yasası çoğu sıvının kaynama noktası sırasındaki buharlaşma entropisinin yaklaşık 85-88 J K−1 mol−1, olduğunu söyler Bu buharlaşma entropisi buharlaşma entalpisinin kaynama sıcaklığına oranıdır. Yasa ismini Frederick Thomas Trouton'dan almıştır.
Kimyasal tepkimelerde giren ve ürünün derişimlerinin sabit olması durumuna kimyasal denge olarak adlandırılmaktadır.

Yunan harfi σ (sigma) ile gösterilen fiziksel bir sabit olan Stefan-Boltzmann sabiti, Stefan-Boltzmann yasasında orantı sabitidir: "Termodinamik sıcaklığın dördüncü kuvvetiyle orantılı olan siyah cismin sıcaklığı arttıkça, tüm dalga boylarına yayılan toplam yoğunluğu da artar" şeklinde açıklanabilmektedir. Termal radyasyon teorisi, moleküler, atomik ve atom altı seviyelerle ilişki kurmak için fiziği kullanarak kuantum mekaniği teorisini ortaya koyar. Sloven fizikçi Josef Stefan, sabiti 1879'da formüle etti ve daha sonra 1884'te Avusturyalı fizikçi Ludwig Boltzmann tarafından da türetildi. Denklem aynı zamanda Planck yasasından, belirli bir sıcaklıktaki tüm dalga boyları üzerinden küçük bir düz siyah cisim kutusunu temsil edecek şekilde bütünleştirilerek türetilebilir. "Yayılan termal radyasyon miktarı hızla artar ve radyasyonun ana frekansı sıcaklık arttıkça yükselir". Stefan-Boltzmann sabiti, ona çarpan tüm ışıyan enerjiyi emen ve yayan bir kara cisim tarafından yayılan ısı miktarını ölçmek için kullanılabilir. Ayrıca, Stefan-Boltzmann sabiti sabit sıcaklıklarda (K) yoğunluk birimine (W⋅m−2) dönüştürülmesine de olanak sağlar.
Elektrokimyada Nernst denklemi, bir elektrokimyasal reaksiyonun indirgenme potansiyelini ; indirgeme ve oksidasyona uğrayan kimyasal türlerin standart elektrot potansiyeli, sıcaklığı ve aktiflikleri ile ilişkilendiren bir denklemdir. Denklemi formüle eden Alman fiziksel kimyacı Walther Nernst'in adını almıştır.
















