
Bakır, Cu sembollü ve 29 atom sayılı bir kimyasal elementtir. Çok yüksek termal ve elektrik iletkenliği olan yumuşak, dövülebilir ve sünek bir metaldir. Yeni açığa çıkmış saf bakır yüzeyi pembemsi-turuncu renklidir. Bakır, ısı ve elektrik iletkeni olarak yapı malzemelerinde, çeşitli metal alaşımların bileşiminde, som gümüş gibi kuyumculukta, kupronikel denizcilik donanımı ve madenî para yapımında ve konstantan yük ölçerlerde ve sıcaklık ölçen termokupllarda kullanılır.

Nikel, atom numarası 28 olan ve simgesi Ni olan kimyasal bir elementtir.

Çinko, sembolü Zn, atom numarası 30 olan kimyasal bir elementtir. Oda sıcaklığında hafif kırılgan bir metaldir ve oksidasyon giderildiğinde parlak gri bir görünüme kavuşur. Periyodik tablonun 12. (IIB) grubunun ilk elementidir. Bazı açılardan çinko kimyasal olarak magnezyuma benzer: her iki element de yalnızca bir normal oksidasyon durumu (+2) gösterir ve Zn2+ ve Mg2+ iyonları benzer boyuttadır. Çinko, Dünya kabuğundaki en bol bulunan 24. element olup beş kararlı izotopu vardır. En yaygın çinko cevheri, bir çinko sülfür minerali olan sfalerittir.

Kurşun (Pb) atom numarası 82, atom kütlesi 207,19 olan mavi-gümüş rengi karışımı bir elementtir. 327,5 °C'ta erir ve 1740 °C'ta kaynar. Doğada, kütle numaraları 208, 206, 207 ve 204 olmak üzere 4 kararlı izotopu vardır.
Tiyoüre, altın ve gümüş ile kompleks yapabilen bir reaktiftir. Altın ve gümüşün tiyoüre ile liçi 1941’den beri bilinmesine rağmen günümüzde pek çok araştırmacının ilgisini çekmekte, Au ve Ag için alternatif bir ekstraksiyon prosesi olarak düşünülmektedir. Tiyoüre uygun bir oksitleyici ile metalik altın ve gümüşü çözündürebilir. Tiyoürenin klasik siyanürlemeye göre avantajları;
- Alkali çözeltilere karşın asidik çözelti kullanılması,
- Anyonik metal-siyanür komplekslerine karşın katyonik kompleksler oluşturması,
- Asidik tiyoüre çözeltilerinin, Au ve Ag ekstraksiyonundaki bazı durumlarda toksik ve korozif olmayan bir seçenek olmasıdır.
Elektrokimya, kimya biliminin bir alt dalı olup elektronik bir iletken ile iyonik bir iletken (elektrolit) arayüzeyinde gerçekleşen reaksiyonları inceler. Elektrokimyada amaç kimyasal enerji ve elektrik enerjisi arasındaki değişimi incelemektir.

Redoks atomların oksidasyon durumlarının değiştiği bir tür kimyasal reaksiyondur. Redoks reaksiyonları, kimyasal türler arasında elektronların fiili veya biçimsel aktarımı ile karakterize edilir, çoğunlukla bir tür oksidasyona, diğer türler indirgemeye uğrar. Elektronun çıkarıldığı kimyasal türlerin indirgenmiş olduğu söyleniyor. Başka bir deyişle:
- Oksidasyon, elektronların bir atom ya da molekülden ayrılmasını sağlayan kimyasal tepkimedir.
- Redüksiyon, bir atomun elektron almasını sağlayan kimyasal tepkimedir.

Sülfürik(VI) asit ya da halk arasında bilinen ismi ile zaç yağı, H2SO4, güçlü bir mineral asididir. Olası kâşifi 8. yüzyıl simyacısı Cabir bin Hayyan tarafından yenime uğratıcı, renksiz ve yoğunluğu yüksek sıvı olarak tanımlanmıştır. Suda her konsantrasyonda çözünebilir. Büyük ölçüde korozif oluşu, güçlü asidik yapısından ve dehidrasyon özelliğinden kaynaklanmaktadır.

Küprik sülfat ya da sadece bakır sülfat olarak da bilinen Bakır (II) sülfat, kimyasal formülü CuSO4 olan bir kimyasal bileşiktir. Bu tuzun hidrasyon derecelerine bağlı olarak bir dizi farklı bileşikleri mevcuttur. Susuz formu soluk yeşil ya da grimsi beyaz bir toz olmasına karşın en çok bilinen pentahidrat (CuSO4•5H2O) formu, parlak mavi renktedir. Çok az miktardaki CuSO4•5H2O çevreye çok zehirlidir, gözleri ve cildi tahriş eder ve yutulduğunda zararlı da olabilir. Oktahedral moleküler geometriye ve paramanyetik özelliğe sahip olan bakır (II) sülfat ekzotermik olarak suda çözünürek [Cu(H2O)6]2+ kompleksini oluşturur. Bakır (II) sülfat "mavi vitriyol", "göztaşı" ve "göktaşı" olarak da bilinmektedir.

Borik asit, aynı zamanda borasis asit, ortoborik asit ya da hidrojen borat; genellikle antiseptik, böcek ilacı ve koku gidericilerde kullanılan beyaz kristal renkli, suda çözünen bir inorganik asit. İlk olarak Wilhelm Homberg tarafından bulunmuş olup, sülfürik asidin yan ürünü olarak ortaya çıkmıştır.
Liç işlemi temel olarak hidrometalurjik zenginleştirme yöntemlerinden biridir. Pirometalurjik işlemlere kıyasla, liçin uygulaması çok daha kolay ve işlem sırasında herhangi bir gaz salınımı olmadığı için çevreye çok fazla zarar vermemektedir. Liçin tek dezavantajı ise, düşük sıcaklık nedeniyle kimyasal reaksiyonların yavaş gerçekleşmesi ve bunun sonucunda tüm işlemin yavaş olmasıdır.

Cevher hazırlama, temel olarak, kıymetli mineralleri cevherden ayırma işlemidir. Endüstriyel ölçekli cevher hazırlama işlemleri birçok aşamadan oluşur. Cevher temelde fiziksel, kimyasal ve fizikokimyasal özelliklerinden oluşan farklara göre ayrılmaktadır.
Hidrometalurji temel olarak, sıvı kimyasalların kullanılmasıyla uygulanan ekstraktif metalurji yöntemlerden biridir. Temel amaç, kıymetli metalleri cevherden ayırmak, zenginleştirmek veya geri dönüştürmektir.
Pirometalurji ekstraktif metalurji dallarından biridir. Temel amacı; kıymetli metalleri kazanmak için, cevhere bir dizi ısıl işlem uygulamak ve malzemenin bu işlemler sonucu fiziksel ve kimyasal olarak değişime uğramasını sağlamaktır. Bu şekilde kıymetli metallerin kazanılması hedeflenir.

Bakır(I) oksit ya da küproz oksit formülü Cu2O olan inorganik bileşiktir. Bakırın oksitlerinden biridir. Bu kırmızı renkli katı bazı yosun önleyici boyaların bileşimine girmektedir. Bu bileşik, tanecik büyüklüğüne bağlı olarak sarı ya da kırmızı renkli olabilir. Bakır(I) oksit kırmızımsı renkteki kuprit minerali halinde bulunur.

Hidrotermal baca, jeotermal ısıya sahip suyun salındığı bir deniz tabağı yarığıdır.

Baryum sülfat BaSO4 formüllü inorganik bileşik. Bu beyaz kristal katı renksizdir ve suda çözünmez. Barit halinde bulunur.
Sülfür döngüsü, sülfürün (kükürt) kayalar, su yolları ve canlı sistemler arasında hareket ettiği süreçlerin toplamıdır. Bu tür biyojeokimyasal döngüler birçok minerali etkilemelerinden dolayı jeolojide önemlidirler. Biyokimyasal döngüler yaşam için de önemlidir, çünkü sülfür birçok proteinin ve kofaktörün bileşeni olan önemli bir elementtir ve sülfür bileşikleri mikrobiyal solunumda oksidan veya indirgeyici olarak kullanılabilir. Küresel kükürt döngüsü, kükürt türlerinin farklı oksidasyon halleri arasındaki geçişlerini içerir ve kükürtün oksidasyon hali hem jeolojik hem de biyolojik süreçlerde önemli bir rol oynar.

Baryum klorür, BaCl2 formüllü inorganik bir bileşik'tir. Bu bileşik baryum'un suda-çözünen en yaygın tuzlarından biridir. Diğer baryum tuzlarının çoğu gibi, baryum klorür beyaz toz halinde ve zehirlidir. Alevde sarı-yeşil renk verir. Ayrıca higroskopiktir, ilk önce dihidrat BaCl2(H2O)2' ye dönüşür.
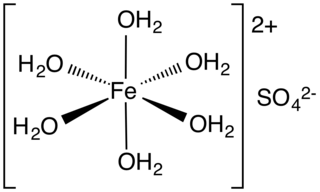
Demir (II) sülfat veya demir sülfat FeSO4•xH2O formülüne sahip bir dizi tuz anlamına gelir. Bu bileşikler en yaygın olarak heptahidrat (x = 7) olarak bulunursa da x için birkaç değer bilinmektedir. Hidratlı form tıp alanında demir eksikliğini tedavi etmek ve ayrıca endüstriyel uygulamalar için kullanılır. Antik çağlardan beri, Zaç-ı Kıbrıs ve yeşil vitriyol (vitriyol, sülfat için eski bir isimdir) olarak bilinen, mavi-yeşil heptahidrat (7 molekül su içeren hidrat) bu maddenin en yaygın şeklidir. Tüm demir (II) sülfatlar suda çözünerek oktahedral moleküler geometriye sahip ve paramanyetik olan aynı akua kompleksi [Fe(H2O)6]2+ verir.













