Hidrojen klorür ya da Kloran, HCl formülüne sahip renksiz, zehirli bir gazdır. Hidrojen ve klor elementlerin oluşan inorganik bileşiktir. Havadaki nem ile temasında beyaz hidroklorik asit dumanı oluşturur. Hidroklorik asit, hidrojen klorürün sulu çözeltisine verilen addır.

Kral suyu, asitlerin az etki ettiği ya da etki etmediği altın ve platin gibi metallerle tepkimeye girebilen kuvvetli bir asit çözeltisidir. Hidroklorik asit ve nitrik asitin 3:1 oranında karıştırılmasıyla oluşur. Ebu Musa Câbir bin Hayyan tarafından bulunduğu tahmin edilmektedir.

Hidroklorik asit, hidrojen ve klor elementlerinden oluşan, oda sıcaklığı ve normal basınçta gaz hâlinde olan hidrojen klorürün sulu çözeltisine verilen ad. Halk arasında tuz ruhu olarak da bilinir. 9. yüzyılda simyacı Câbir bin Hayyân tarafından keşfedildi ve sonrasında simya alanında kullanıldı. Sanayi Devrimi sırasında, sanayideki önemi keşfedilen asit, önce Leblanc işlemi, sonrasında Solvay işlemi ile sanayi alanında üretilmeye başladı. Hidroklorik asit, tarihte yeni kolaylıkların keşfinde önemli roller üstlendi. Günümüzde PVC'den demir-çeliğe, organik madde üretiminden gıda sektörüne kadar hemen hemen tüm alanlarda hidroklorik asit kullanılmaktadır.
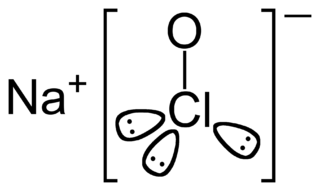
Sodyum hipoklorit, (NaClO) bir tür tuzdur. Günlük hayatta beyazlatıcı çamaşır sularında kullanılmaktadır. Oda koşullarındaki klor ile sabunlardaki sodyum hidroksit tepkimeye sokularak üretilmektedir.

Sodyum bisülfat, diğer bir adı sodyum hidrojen sülfat (NaHSO4) olan bu kimyasal madde asit tuz karakterlidir. Kuru halde iken güvenli bir şekilde nakledilebilir ve depolanabilir. Susuz formu higroskopiktir. Sodyum bisülfat suda hidroliz olarak asidik çözelti verir. 1 Molarlık çözeltisinin pH değeri 1 den küçüktür. Sodyum bisülfat yavaşça ısıtılırsa suyunu kaybederek sodyum pirosülfata dönüşür.
- 2NaHSO4 → Na2S2O7 + H2O

Hipokloröz asit, HOCl formülüne sahip bir zayıf asittir.

Amonyum klorür ya da daha çok bilinen adıyla Nişadır, formülü NH4Cl olan bir kimyasal bileşiktir. Suda yüksek oranda çözünen, beyaz kristallere sahip bir tuzdur. Amonyum klorür çözeltileri hafif asidiktir. Doğada mineral halde bazı volkan bacalarının etrafında bulunan haline sal amonyak denir. Bazı tür meyan ballarında bir aroma maddesi olarak kullanılır. Nişadır, hidroklorik asit ve amonyak arasında gerçekleşen reaksiyonla sonucu oluşur.

İyot monoklorür ICl formülü ile gösterilen bir interhalojen bileşiktir. Oda sıcaklığına yakın eriyen kırmızı-kahverengi renge sahip bir kimyasal bileşiktir. İyot ve klorun elektronegatifliği arasındaki fark nedeniyle, ICl oldukça kutupsaldır ve I+ kaynağı olarak davranır.

İyodik asit, HIO3, beyaz veya kirli beyaz bir katı madde olarak elde edilebilir. Suda çok iyi çözünür, ancak klorik asit veya bromik asidin aksine saf halde bulunur. İyodik asit +5 oksidasyon durumunda iyot içerir ve halojenlerin saf halde en stabil okso-asitlerinden biridir. İyot asidi dikkatle ısıtıldığında pentoksit iyice dehidre olur. Daha sonraki ısıtmada, iyot pentoksit ayrıca iyot, oksijen ve düşük iyot oksitleri karışımı vererek ayrışır.

Hidrojen iyodür (HI) iki atomlu bir molekül ve hidrojen halojenürdür. Sulu çözeltisi, güçlü bir asit olan hidroiyodik asit veya hidriyodik asit olarak bilinir. Bununla birlikte, hidrojen iyodür ve hidroiodik asit, birincisinin standart koşullar altında bir gaz olması, diğerinin ise söz konusu gazın sulu bir çözeltisi olması bakımından farklıdır. Birbirine dönüştürülebilir. HI, organik ve inorganik sentezlerde birincil iyot kaynaklarından biri ve bir indirgeyici madde olarak kullanılır.
Benzil klorür, C
6H
5CH
2Cl formüllü organik bileşik. Kimyasal tepkimelerde çokça kullanılan renksiz sıvı. Kaynama noktası 179 °C'dir. Suda çözünmez. Etanol, dietil eter, kloroform ve karbon tetraklorürde çözünür.

Kloroplatinik asit (hekzakloroplatinik asit olarak da bilinir), [H3O]2[PtCl6](H2O)x (0≤x≤6) formülüne sahip bir inorganik bileşiktir. Kırmızı bir katı, genellikle sulu bir çözelti olarak önemli bir platin kaynağıdır. Genellikle kısaca H2PtCl6 olarak yazılsa da, hekzakloroplatinat anyonunun (PtCl62-) hidronyum (H3O+) tuzudur. Hekzakloroplatinik asit oldukça higroskopiktir.
Amonyum hidroksit, oda sıcaklığında gaz hâlde bulunan amonyağın sulu çözeltisine verilen addır. Formülü olarak NH4+.OH- gösterilir.

Bakır karbonat, oda sıcaklığında katı hâlde bulunan bir inorganik bileşiktir. Havadan nem çeker. Su ile tepkimeye girerek bakır karbonat hidroksite dönüşür. Bazik özellik gösterir. Boya ve pigment olarak kullanılır.
Demir (III) klorür FeCl
3 formüllü inorganik bir bileşiktir. Kristal bir katı olmasının yanı sıra görüş açısına bağlı olarak farklı renklerle gözlemlenebilir; koyu yeşil, mor-kırmızı. Sulu formu da katı formu da fiziksel görünüm olarak koyu kahverengi rengindedir.

Baryum klorür, BaCl2 formüllü inorganik bir bileşik'tir. Bu bileşik baryum'un suda-çözünen en yaygın tuzlarından biridir. Diğer baryum tuzlarının çoğu gibi, baryum klorür beyaz toz halinde ve zehirlidir. Alevde sarı-yeşil renk verir. Ayrıca higroskopiktir, ilk önce dihidrat BaCl2(H2O)2' ye dönüşür.

Organik kimyada, bir açil klorür (veya asit klorür) -COCl fonksiyonel grubuna sahip bir organik bileşiktir. Formülleri genellikle RCOCl şeklinde yazılır. Burada R bir yan zincirdir. Karboksilik asitlerin reaktif türevleridir. Açil klorürün özgün bir örneği, CH3COCl, asetil klorür'dür. Açil klorürler açil halojenürlerin en önemli alt kümesidir.

Hell-Volhard-Zelinski halojenasyon reaksiyonu, α karbonunda bir karboksilik asitin halojenasyonunu içeren kimyasal bir dönüşümdür. Bu reaksiyonun gerçekleşmesi için α karbonunun en az bir proton taşıması gerekir. Reaksiyon, Alman kimyagerler Carl Magnus von Hell (1849-1926) ve Jacob Volhard (1834-1910) ile Rus kimyager Nikolay Zelinski'nin (1861-1953) adını almıştır.


Hekzakloroaseton, (Cl3C)2CO formülüne sahip organik bir bileşiktir Aynı zamanda hekzakloropropanon veya perkloroaseton olarak da adlandırılır. Tüm olası pozisyonlar klor ile ikame edildiğinden, klor atomlarının pozisyonunu gösteren sayılar genellikle ihmal edilir. Suda az çözünen renksiz bir sıvıdır.
Çinko klorür, ZnCl2·nH2O formülüne sahip, n değeri 0 ila 4,5 arasında değişen hidratlar oluşturan inorganik bir kimyasal bileşiktir. Susuz çinko klorür ve hidratları renksiz veya beyaz kristal katılardır ve suda oldukça çözünür. Beş çinko klorür hidratının yanı sıra dört susuz çinko klorür formu bilinmektedir. Çinko klorürün tüm formları nem çeker. Çinko klorür tekstil işlemede, metalurjik akılarda ve kimyasal sentezde geniş uygulama alanı bulur.

 .
.

















