
Sodyum, periyodik cetvelde Na simgesi ile gösterilen ve atom numarası 11 olan element. Sodyum yumuşak ve kaygan bir metal olup alkali metaller grubuna aittir. Doğal bileşiklerin içinde bol miktarda bulunur. Yüksek oranda reaktiftir, sarı bir alevle yanar, su ile şiddetli reaksiyon verir ve havada hızla oksitlenir. Dolayısıyla, vazelin, gazyağı gibi hava ve su ile temasını kesecek bir ortamda saklanması gerekir.

Tuz, kimyada, bir asitle bir bazın tepkimeye girmesi neticesinde meydana gelen maddedir. Tuz, asitteki eksi yüklü iyonla (anyon) bazdaki artı yüklü iyondan (katyon) meydana gelir. Asitle baz arasındaki nötralleşme tepkimesi esnasında tuz ve su açığa çıkar. Erimiş tuz veya çözelti halindeki tuzların çoğu eksi ile artı yüklü iyonlarına ayrışır ve elektriği iletir. Tuz adı ayrıca sofra tuzu veya sodyum klorür (NaCl) için de kullanılır.
İnorganik kimya veya anorganik kimya; organik olmayan, yani karbon-hidrojen bağı içermeyen bileşiklerin özelliklerini ve kimyasal davranışlarını inceleyen kimya dalı. Anorganik ve organik kimyayı birleştiren organometalik bileşikler, organometalik kimya adında başka bir dalı oluşturur.
Baz, suda iyonlaştıklarında ortama OH− (hidroksit) iyonu ve elektron çifti verebilen maddelerdir. Bazlar da, asitler gibi tehlikeli maddelerdir. Suda iyonlaştıklarında hidroksit (OH−) iyonu derişimini arttıran maddelere baz denir. Bilinen en güçlü baz Sezyum hidroksittir (CsOH).

Potasyum nitrat, formülü KNO3 olan bir potasyum bileşiğidir. Güherçile olarak da bilinen bileşik doğal hâlde kayaçlarda ve mağaralarda oluşan beyaz renkli kabuksu yapıda bulunur.

Gümüş nitrat en önemli gümüş tuzudur. Renksiz ağır kristallerden oluşur. Tıpta dağlamak maksadıyla kullanılır ve antibakteriyel özelliği vardır. Bu özelliğinden dolayı siğil tedavisinde sıkça kullanılır. Ayrıca deriyi ve organik maddeleri karartmada tercih edilir. Deriyi kararttığından cehennem taşı ismini almıştır. Suda ve alkolde kolayca çözündüğünden birçok gümüş bileşiklerinin elde edilmesinde ilkel madde olarak kullanılır. En çok kullanıldığı yerler, başta fotoğrafçılık olmak üzere mürekkepler, saç boyası yapımı ve gümüş kaplamacılığıdır.bileşenleri gümüş ve nitrik asittir. Sentezi ise örnekteki formüle göre yapılır:
- Ag + 2 HNO3 → AgNO3 + NO2 + H2O
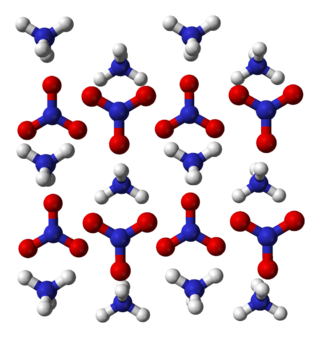
Amonyum nitrat, amonyum ve nitrat iyonlarından oluşan, NH4NO3 formülüne sahip yüksek patlayıcı bir kimyasal bileşiktir. Higroskopik özellikte ve beyaz kristal bir katı olarak hidrat oluşturmasa da suda çok çözünür. Ağırlıklı olarak, tarımda yüksek azotlu gübre olarak kullanılmaktadır. 2017 yılında küresel üretimi 21.6 milyon ton olarak tahmin edildi.

Sodyum nitrat formülü NaNO3 olan kimyasal bileşiktir. Güherçile'den ayırmak için Şili güherçilesi (bu ülkede büyük miktarda yığınlar halinde bulunması nedeniyle bu ad verilmiştir) adı da verilen bu beyaz renkli kristal tuz, potasyum nitrata oranla suda çok fazla çözünmektedir. Havadan nem çeker.
Stronsiyum nitrat formülü Sr(NO3)2 olan inorganik bileşiktir. Beyaz kristallere sahip bu bileşik piroteknik bileşimlerde kırmızı renk vermek için kullanılır.

Çinko nitrat, formülü Zn(NO3)2 olan bir çinko bileşiğidir. Bu beyaz, kristal katı bileşik havadan çok nem çekerek sulanır ve genellikle hekzahidrat Zn(NO3)2•6H2O formunda bulunmaktadır. Çinko nitrat su ve alkolde çözünür.

Baryum asetat (Ba(C2H3O2)2) baryum(II) ve asetik asitin tuzu.
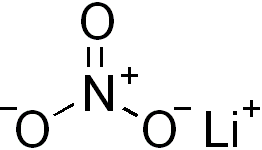
Lityum nitrat LiNO3 formüllü inorganik bileşik. Nitrik asitin lityum tuzudur. Lityum karbonat veya lityum hidroksitin nitrik asit ile reaksiyonundan elde edilir.

Bakır (II) nitrat Cu(NO3)2(H2O)x formülüne sahip inorganik bileşikler ailesinin herhangi bir üyesini tanımlar. Hidratlar mavi katılardır. Susuz bakır nitrat mavi-yeşil kristaller oluşturur ve 150-200 °C'de vakumda süblimleşir. Yaygın hidratlar hemipentahidrat ve trihidrattır.
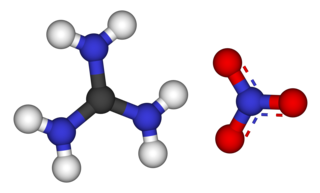
Guanidin nitrat [C(NH2)3]NO3 formülüne sahip kimyasal bir bileşiktir. Renksiz, suda çözünür bir tuzdur. Gaz jeneratörü ve katı yakıtlı roket motoru itici yakıt uygulamaları olarak kullanılan yüksek enerjili yakıt olarak büyük ölçüde üretilmektedir. Esas adı guanidinyum nitrat olsa da guanidin nitrat ifadesi yanlış ve yaygın olarak kullanılmaktadır.

Magnezyum nitrat Mg(NO3)2(H2O)x formülüne sahip inorganik bileşikleri ifade eder. Formüldeki, x = 6, 2 ve 0 olabilir. Hepsi beyaz renkli katılardır. Susuz madde higroskopiktir, havada bekletildiğinde hızlı bir şekilde hekzahidrat oluşturur. Bütün tuzları hem suda hem de etanolde çok çözünür.

Mangan(II) nitrat Mn(NO3)2•(H2O)n formülüne sahip bir inorganik bileşiktir. Her formül birimi bir Mn2+ katyon ve iki NO3− anyonu ile değişen miktarlarda sudan oluşur. En yaygın olanı tetrahidrat Mn(NO3)2•4H2O dır. Fakat, susuz bileşiğin yanı sıra mono ve hekzahidratlar da bilinmektedir. Bu bileşiklerin bazıları, mangan oksitleri için faydalı öncül maddelerdir.

Kalsiyum nitrat, (Norveç güherçilesi) olarak da adlandırılır. Ca(NO3)2 formülüne sahip bir inorganik bileşiktir. Bu renksiz tuz havadan nem çeker ve genellikle bir tetrahidrat olarak bulunur. Esas olarak gübrelerde bileşen olarak kullanılırsa da başka uygulamalarda da kullanılır. Nitrokalsit, çiftlik gübresinin ahır veya mağaralarda olduğu gibi kuru bir ortamda beton veya kireç taşı ile temas ettiği yerlerde bir çiçeklenme olarak oluşan hidratlı bir kalsiyum nitrat olan bir mineralin adıdır. Kalsiyum amonyum nitrat dekahidrat ve kalsiyum potasyum nitrat dekahidrat dahil çeşitli ilgili tuzları bilinmektedir.
Gümüş asetilür, formülü Ag2C2 olan bir metalik asetilür, inorganik kimyevi bileşiktir. Gümüş karbür olarak da bilinir. Nileşik, zayıf bir asit olan asetilenin tuzu olarak kabul edilir. Tuzun anyonu birbirine üçlü bağla bağlanmış iki karbon atomundan oluşur.

Baryum klorür, BaCl2 formüllü inorganik bir bileşik'tir. Bu bileşik baryum'un suda-çözünen en yaygın tuzlarından biridir. Diğer baryum tuzlarının çoğu gibi, baryum klorür beyaz toz halinde ve zehirlidir. Alevde sarı-yeşil renk verir. Ayrıca higroskopiktir, ilk önce dihidrat BaCl2(H2O)2' ye dönüşür.

Uranil nitrat, UO2(NO3)2.n H2O formülüne sahip, suda çözünür sarı renkli bir uranyum tuzudur. Hekza-, tri- ve dihidratlar bilinmektedir. Bileşik esas olarak nükleer yakıtların hazırlanmasında bir ara madde olarak kullanılma potansiyeliyle ilgi çekmiştir.





















