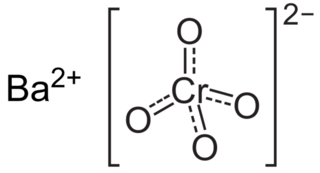Fisyon, kütle numarası çok büyük bir atom çekirdeğinin parçalanarak kütle numarası küçük iki veya daha fazla çekirdeğe dönüşmesi olayıdır. Fisyon reaksiyonlarında radyoaktif elementler kullanılır ve tepkimeler için bir ilk enerjiye ihtiyaç vardır. Reaksiyon sonucunda kararsız çekirdekler ve nötron oluşur. Oluşan nötronların her biri yeni bir uranyum atomu ile tepkimeye girer. Bu esnada açığa çıkan nötronlar ortamdan uzaklaştırılmazsa tepkime zincirleme olarak devam eder.

Klor, VIIA grubunda bulunan hafif, keskin kokulu, yeşilimsi sarı renkli, tahriş edici ve zehirleyici bir gaz. Havadan 2,5 kat ağır olan klor ilk zamanlar bir bileşik olarak kabul ediliyordu. Klor ilk olarak 1774 yılında Carl Wilhelm Scheele tarafından keşfedildi. 1810 yılında ise bugünkü ismi Humphry Davy tarafından verildi.
Amil asetat (pentil asetat) organik bileşik olup, CH3COO(CH2) 4CH3 kimyasal formülüne ve 130.19 g/mol molekül ağırlığına sahip bir esterdir. Renksizdir. Muz ve elma benzeri bir kokuya sahiptir. Bileşik, asetik asit ve 1-pentanolün yoğunlaşma ürünüdür. Bununla birlikte, diğer pentanol izomerlerinden (amil alkoller) veya amil alkol karışımlarından oluşturulan esterler genellikle amil asetat olarak adlandırılır. İnsanlarda amil asetata maruz kalma belirtileri dermatit, merkezî sinir sistemi depresyonu, narkoz ve gözlerde ve burunda tahriştir.
İnorganik kimya veya anorganik kimya; organik olmayan, yani karbon-hidrojen bağı içermeyen bileşiklerin özelliklerini ve kimyasal davranışlarını inceleyen kimya dalı. Anorganik ve organik kimyayı birleştiren organometalik bileşikler, organometalik kimya adında başka bir dalı oluşturur.

Karboksilik asitler karboksil grubu olan organik asitlerdir, -C(=O)OH formülüne sahiptirler, bu genelde -COOH veya CO2H olarak da yazılır. Karboksilik asitler Bronsted asitleridir, yani proton vericileridir. Karboksilik asitlerin tuz ve anyonlarına karboksilat denir. Karboksilik asitler, esterlerle fonsiyonel grup izomeridirler. Karboksilik asitlerin en basit dizisi alkanoik asitlerdir, R-COOH formülüyle gösterilirler, R bir hidrojen atomu veya bir alkil grubuna karşılık gelir. Bileşiklerde birden fazla karboksilik asit grubu bulunabilir.

Kimyada esterler, bir hidroksil grubundaki hidrojen atomunun bir organik grup (bu metinde R' olarak gösterilecektir) ile yer değiştirmiş olduğu organik bileşiklerdir. Hidrojenin bir H+ iyonu olarak ayrışabileceği -OH grubu olan bu tür asitlere oksijen asidi denir.
Kimyada bir dehidrasyon veya kondenzasyon tepkimesi, tepkiyen moleküllerden su kaybının meydana geldiği bir kimyasal tepkimedir. Dehidrasyon tepkimeleri eliminasyon tepkimelerinin bir alt grubudur. Hidroksil grubu (-OH) kolay ayrılan bir grup olmadığı için bir Bronsted asit katalizörü hidroksil grubunu protonlaştırıp daha kolay ayrılan bir -OH2+ grubu oluşturur. Selülozlar Bu gruba dahil değildirler.

Sülfürik(VI) asit ya da halk arasında bilinen ismi ile zaç yağı, H2SO4, güçlü bir mineral asididir. Olası kâşifi 8. yüzyıl simyacısı Cabir bin Hayyan tarafından yenime uğratıcı, renksiz ve yoğunluğu yüksek sıvı olarak tanımlanmıştır. Suda her konsantrasyonda çözünebilir. Büyük ölçüde korozif oluşu, güçlü asidik yapısından ve dehidrasyon özelliğinden kaynaklanmaktadır.

Asetik asit veya etanoik asit CH3COOH formüllü bir organik asittir, sirkeye ekşi tadını ve keskin kokusunu vermesiyle bilinir. Bu yüzden halk arasında sirke ruhu veya sirke asidi şeklinde de adlandırılır. Karboksilik asitlerin en küçüklerindendir (en küçük olan formik asittir). Doğada karbonhidratların yükseltgenmesiyle oluşur. Sanayide asetik asit hem biyolojik yolla hem de sentetik yolla imal edilir. Tuz ve esterine asetat denir. Suda tamamen çözünür.

Etil asetat (sistematik adıyla etil etanoat, kısa yazımla EtOAc veya EA), CH3COOCH2CH3 formüllü bir organik bileşiktir. Bu renksiz sıvı bileşiğin bazı yapıştırıcılar ve oje gibi tatlı bir kokusu vardır. Zehirli değildir. Etil asetat, etanol ve asetik asitin esteri olup, sanayide güçlü bir çözücü olması nedeniyle sık üretilen bir maddedir. Yapıştırıcılar, ojeler, oje çıkarıcılar ve kahveden kafeinin çıkarılmasında sıklıkla kullanılmaktadır.

Baryum nitrat kimyasal formülü Ba(NO3)2 olan baryum ve nitrat iyonundan meydana gelmiş bir tuzdur.

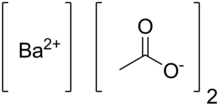
Asetat genellikle sulu çözeltiler içinde bulunan negatif iyon ya da anyon. Kimyasal formülü C2H3O2-,CH3CO2- veya CH3COO- şeklinde ifade edilir. Asetik asidin tuzu veya esteridir. Sanayide yılda 5 milyar kilogram asetik asit asetat üretiminde kullanılır. Doğada, asetat sentez için en yaygın yapı taşıdır. Örneğin, yağ asitleri büyüyen yağ asidi için asetat iki karbon atomu bağlanarak üretilir.

MeOAc, asetik asit metil esteri ya da metil etanoat olarak da bilinen Metil asetat, formülü CH3COOCH3 olan karboksilli bir esterdir. Karakteristik olarak, bazı tutkallar ve oje çıkarıcıların hoş kokusunu anımsatan yanıcı bir sıvıdır. Metil asetat, zayıf polar ve lipofilik özellikte olduğundan bazen bir solvent olarak kullanılmaktadır. Ancak yakın akrabası olan etil asetat daha az toksik ve suda daha az çözündüğünden dolayı çok daha yaygın kullanılan bir çözücüdür. Metil asetat, oda sıcaklığındaki su içerisinde %25 kadar bir çözünürlüğe sahiptir. Yüksek sıcaklıktaki suda, çözünürlüğü çok daha yüksektir. Metil asetat kuvvetli sulu bazlar ya da sulu asitlerin mevcudiyetinde kararlı değildir.
Bir birleşme tepkimesi 2 veya daha fazla reaktan element ya da bileşiğin bir ürün bileşiği oluşturması için birleştiği tepkime türü. X + Y → gibi bir denklemle temsil edilebilir.
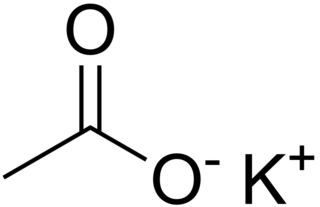
Potasyum asetat (KCH3COO) asetik asitin postasyum tuzu.

Kalsiyum asetat asetik asitin kalsiyum tuzu. Ca(C2H3O2)2 formülü ile ifade edilir. Eski bir ismi kirecin asetatı olarak bilinir. Susuz hali çok higroskopiktir. Bundan dolayı monohidrat formu (Ca(CH3COO)2•H2O) yaygındır.

Asetik anhidrit veya etanoik anhidrit  formüllü bir kimyasal bileşiktir. Organik sentezde çokça kullanılan bir bileşiktir. Güçlü bir asetik asit kokusuna sahiptir, asetik asitin havadaki nemle tepkimesi ile oluşur. Asetat iyonu verdiğinden asetik anhidrit asetilasyon tepkimelerinde kullanılabileceği gibi morfinin asetilasyonunda kullanılır, eroin (diasetilmorfin) üretiminde kullanılır.
formüllü bir kimyasal bileşiktir. Organik sentezde çokça kullanılan bir bileşiktir. Güçlü bir asetik asit kokusuna sahiptir, asetik asitin havadaki nemle tepkimesi ile oluşur. Asetat iyonu verdiğinden asetik anhidrit asetilasyon tepkimelerinde kullanılabileceği gibi morfinin asetilasyonunda kullanılır, eroin (diasetilmorfin) üretiminde kullanılır.
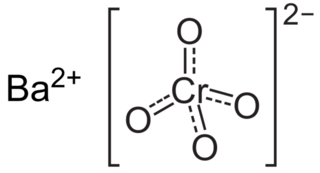
Baryum kromat, BaCrO4 formülüne sahip sarı renkli, kum gibi toz bir maddedir. Bilinen bir oksitleyici maddedir ve baryum iyonlarının bir sonucu olarak ısıtıldığında yeşil bir alev üretir.

İzoamil asetat veya izopentil asetat, izoamil alkol ve asetik asit esteri olan organik bileşik. Bu renksiz, yağımsı sıvı muz veya armuda benzeyen bir kokuya sahiptir parfümlerde koku, gıdalarda muz tadı vermek için kullanılır ayrıca sanayide çözücü olarak kullanılır. Bu madde doğal muzda az miktardada olsa oluşur muzların esans yağının bir parçasıdır. Toksititesi az ve az miktarlarda bile hissedildiğinden gaz maskelerini test etmek için kullanılabilir.

Benzil asetat, benzil alkol ve asetik asit esteridir, şeftali kokusuna sahiptir.