Bakır(II) nitrat
 | |||
| |||
| Adlandırmalar | |||
|---|---|---|---|
Bakır(II) nitrat | |||
Diğer adlar Küprik nitrat | |||
| Tanımlayıcılar | |||
CAS numarası |
| ||
3D model (JSmol) | |||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.019.853 | ||
PubChem CID | |||
| RTECS numarası |
| ||
| UNII |
| ||
CompTox Bilgi Panosu (EPA) | |||
| |||
| |||
| Özellikler | |||
| Molekül formülü | Cu(NO3)2 | ||
| Molekül kütlesi | 187.5558 g/mol (susuz) 241.60 g/mol (trihidrat) 232.591 g/mol (hemipentahidrat) | ||
| Görünüm | mavi kristaller higroskopik | ||
| Yoğunluk | 3.05 g/cm3 (susuz) 2.32 g/cm3 (trihidrat) 2.07 g/cm3 (hekzahidrat) | ||
| Erime noktası | 114 °C (susuz, bozunur) 114.5 °C (trihidrat) 26.4 °C (hekzahidrat, bozunur) | ||
| Kaynama noktası | 170 °C (trihidrat, bozunur) | ||
| Çözünürlük (su içinde) | trihidrat:[3] 381 g/100 mL (40 °C) 666 g/100 mL (80 °C) hekzahidrat:[3] 243.7 g/100 mL (80 °C) | ||
| Çözünürlük | hidratlar etanol, amonyak, suda çok çözünür; etil asetatta çözünmez | ||
| +1570.0•10−6 cm3/mol (~3H2O) | |||
| Yapı | |||
| ortorombik (susuz) rombohedral (hidratlar) | |||
| Tehlikeler | |||
| İş sağlığı ve güvenliği (OHS/OSH): | |||
| Ana tehlikeler | Tahriş edici, Oksitleyici | ||
| NFPA 704 (yangın karosu) | |||
| NIOSH ABD maruz kalma limitleri: | |||
| PEL (izin verilen) | TWA 1 mg/m3 (Cu olarak)[4] | ||
| REL (tavsiye edilen) | TWA 1 mg/m3 (Cu olarak)[4] | ||
| IDLH (anında tehlike) | TWA 100 mg/m3 (Cu olarak)[4] | ||
| Güvenlik bilgi formu (SDS) | Cu(NO3)2•3H2O | ||
| Benzeyen bileşikler | |||
Diğer anyonlar | Bakır(II) sülfat Bakır(II) klorür | ||
Diğer katyonlar | Gümüş nitrat Altın(III) nitrat | ||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |||
Bakır (II) nitrat Cu(NO3)2(H2O)x formülüne sahip inorganik bileşikler ailesinin herhangi bir üyesini tanımlar. Hidratlar mavi katılardır. Susuz bakır nitrat mavi-yeşil kristaller oluşturur ve 150-200 °C'de vakumda süblimleşir.[5] Yaygın hidratlar hemipentahidrat ve trihidrattır.
Sentezi ve reaksiyonları
Hidratlı bakır(II) nitrat
Hidratlı bakır nitrat, bakır metali veya oksidinin nitrik asitle işlenmesiyle hazırlanır:[6]
- Cu + 4 HNO3 → Cu(NO3)2. + 2 H2O + 2 NO2
Aynı tuzlar, bakır metalinin gümüş nitratın sulu çözeltisi ile reaksiyonuyla da hazırlanabilir. Bu reaksiyon, bakır metalinin gümüş iyonlarını indirgeme yeteneğini göstermektedir. Sulu çözeltide, hidratlar sulu kompleks [Cu(H2O)6]2+ olarak bulunur. Bu tür kompleksler, bakır (II)ın d9 elektronik konfigürasyonu nedeniyle oldukça kararsızdır.
Hidratlı bakır (II) nitratlardan herhangi birinin ısıtılarak kurutulmaya çalışılması, Cu(NO3)2 yerine oksitleri verir. Hidratlar 80 °C'de, "bazik bakır nitrat"a (Cu2(NO3)(OH)3), 180 °C’de ise CuO’e dönüşür.[6] Bu reaksiyondan yararlanılıp, bakır nitratı, bozunana kadar ısıtıp oluşan gazı doğrudan suya geçirerek nitrik asit üretmek mümkündür. Bu yöntem, Ostwald işlemindeki son adıma benzer. Denklemler aşağıdaki gibidir:
- 2 Cu(NO3)2 → 2 CuO + 4 NO2 + O2
- 3 NO2 + H2O → 2HNO3 + NO
Bakır(II) nitrat çözeltilerinin trifenilfosfin, trifenilarsin ve trifenilstibin ile muamele edilmesi bakır(I) komplekslerini [Cu(E(C6H5)3)3]NO3 (E = P, As, Sb) verir. Grup V ligandı okside oksitlenir.[7]
Susuz bakır(II) nitrat
Susuz Cu(NO3)2 iki polimorfu bilinmektedir. β-formu, süblimleşme eğilimi ile kanıtlandığı gibi, kovalent bir moleküler komplekstir. Az sayıdaki susuz geçiş metali nitratlarından biridir.[8] Su içeren veya su üreten reaksiyonlarla hazırlanamaz. Bunun yerine, bakır metali azot tetraoksit ile işlendiğinde susuz Cu(NO3)2 oluşur:
- Cu + 2 N2O4 → Cu(NO3)2 + 2 NO
Susuz bakır(II) nitratın α-formu bir koordinasyon polimeridir.[1]
Yapısı
Susuz bakır(II) nitrat

Susuz bakır(II) nitrat’ın yapısı.
Susuz bakır(II) nitrat iki solvatsız polimorfta kristalize edilmiştir.[1][2] α- ve β-Cu(NO3)2 tamamen 3D koordinasyon polimer ağlarıdır. Alfa formunun [4+1] koordinasyonlu yalnızca bir Cu ortamı vardır, ancak beta formunun biri [4+1] ve diğeri kare düzlem olmak üzere iki farklı bakır merkezi vardır. Nitrometan solvatı ayrıca yaklaşık 200 pm'lik dört kısa Cu-O bağı ve 240 pm'de bir daha uzun bağ ile "[4+ 1] koordinasyona" sahiptir.[9] Bakır (II) merkezleri ve nitrat gruplarının sonsuz zincirine sahip koordinasyon polimerleridir. Gaz fazında, bakır (II) nitrat, iki çift dişli nitrat ligandına sahiptir (sağ üstteki resme bakın).[10] Bu nedenle, katının buharlaşması, bakır (II) nitrat molekülünü vermek için "kraking"i gerektirir.
Hidratlı bakır(II) nitrat
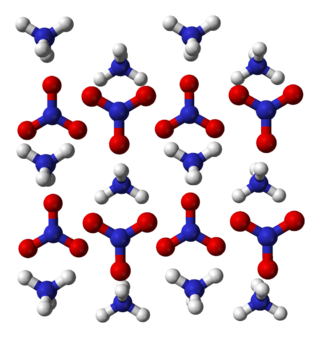
Beş hidrat rapor edilmiştir: monohidrat (Cu(NO3)2•H2O),[2] seskihidrat (Cu(NO3)2•1.5H2O),[11] hemipentahidrat (Cu(NO3)2•2.5H2O),[12] bir trihidrat (Cu(NO3)2•3H2O),[13] ve bir hekzahidrat ([Cu(H2O)6](NO3)2).[14] Hekzahidrat ilginçtir, çünkü Cu-O mesafelerinin tümü eşittir, aksi halde oktahedral Cu(II) komplekslerinin özelliği olan Jahn-Teller distorsiyonunun olağan etkisini ortaya çıkarmaz. Bu etkisizlik, Cu-O bağlarının esnekliğini sınırlayan güçlü hidrojen bağına atfedilir.
Uygulamaları
Bakır(II) nitrat, organik kimyada çeşitli işlemler için katalizör olarak kullanılan bakır(II) oksite dönüştürülmesi başta olmak üzere çeşitli uygulamalar bulur. Çözeltileri tekstillerde ve diğer metaller için parlatıcı maddelerde kullanılmaktadır. Bakır nitratlar bazı pirotekniklerde bulunur.[6] Genellikle okul laboratuvarlarında kimyasal voltaik hücre reaksiyonlarını göstermek için kullanılır. Bazı seramik sırların ve metal patinaların bir bileşenidir.
Organik sentez
Bakır nitrat, asetik anhidrit karışımı, Menke nitrolaması olarak bilinen aromatik bileşiklerin nitrolanması için etkili bir reaktiftir.[15] Kil üzerine absorbe edilen hidratlı bakır nitrat, "Claycop" adı verilen bir reaktif verir. Elde edilen mavi renkli kil, örneğin tiyollerin disülfürlere oksidasyonu için bir bulamaç olarak kullanılır. Claycop ayrıca ditioasetalleri karbonillere dönüştürmek için de kullanılır.[16] Montmorillonite dayalı ilgili bir reaktifin aromatik bileşiklerin nitrolanması için yararlı olduğu kanıtlanmıştır.[17]
Doğal olarak oluşan bakır nitratlar
İdeal Cu(NO3)2 formülüne sahip hiçbir mineral veya hidrat bilinmemektedir. Likasit, Cu3(NO3)(OH)5.2H2O ve buttgenbahit, Cu19(NO3)2(OH)32Cl4•2H2O ilgili minerallerdir.[18][19]
Doğal bazik bakır nitratlar, her ikisi de Cu2(NO3)(OH)3 maddesinin polimorfları olan nadir mineraller olan gerhardtit ve rouait'i içerir.[20][21][22] Çok daha karmaşık, bazik, hidratlı ve klorür içeren bir doğal tuz, buttgenbahit'dir.[19][22]
Kaynakça
- ^ a b c Wallwork, S. C.; Addison, W. E. (1965). "526. The crystal structures of anhydrous nitrates and their complexes. Part I. The α form of copper(II) nitrate". J. Chem. Soc. 1965: 2925-2933. doi:10.1039/JR9650002925.
- ^ a b c Troyanov, S. I.; Morozov, I. V.; Znamenkov, K. O.; Yu; Korenev, M. (1995). "Synthesis and X-Ray Structure of New Copper(II) Nitrates: Cu(NO3)2•H2O and ?-modification of Cu(NO3)2". Z. Anorg. Allg. Chem. 621 (7): 1261-1265. doi:10.1002/zaac.19956210727.
- ^ a b Perrys' Chem Eng Handbook, 7th Ed
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. "#0150". National Institute for Occupational Safety and Health (NIOSH).
- ^ Pass and Sutcliffe (1968). Practical Inorganic Chemistry. Londra: Chapman and Hall.
- ^ a b c H.Wayne Richardson "Copper Compounds" Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a07_567.
- ^ Gysling, Henry J. (1979). "Coordination Complexes of Copper(I) Nitrate". Inorganic Syntheses. Inorganic Syntheses. 19. ss. 92-97. doi:10.1002/9780470132500.ch19. ISBN 9780470132500.
- ^ Addison, C. C.; Logan, N.; Wallwork, S. C.; Garner, C. D. (1971). "Structural Aspects of Co-ordinated Nitrate Groups". Quarterly Reviews, Chemical Society. 25 (2): 289. doi:10.1039/qr9712500289.
- ^ Duffin, B.; Wallwork, S. C. (1966). "The crystal structure of anhydrous nitrates and their complexes. II. The 1:1 copper(II) nitrate-nitromethane complex". Acta Crystallographica. 20 (2): 210-213. doi:10.1107/S0365110X66000434
 .
. - ^ LaVilla, R. E.; Bauer, S. H. (1963). "The Structure of Gaseous Copper(II) Nitrate as Determined by Electron Diffraction". J. Am. Chem. Soc. 85 (22): 3597-3600. doi:10.1021/ja00905a015.
- ^ Dornberger-Schiff, K.; Leciejewicz, J. (1958). "Zur Struktur des Kupfernitrates Cu(NO3)2.1.5H2O". Acta Crystallogr. 11 (11): 825-826. doi:10.1107/S0365110X58002322
 .
. - ^ Morosin, B. (1970). "The crystal structure of Cu(NO3)2.2.5H2O". Acta Crystallogr. B26 (9): 1203-1208. doi:10.1107/S0567740870003898.
- ^ J. Garaj, Sbornik Prac. Chem.-Technol. Fak. Svst., Cskosl. 1966, pp. 35–39.
- ^ Zibaseresht, R.; Hartshorn, R. M. (2006). "Hexaaquacopper(II) dinitrate: absence of Jahn-Teller distortion". Acta Crystallogr. E62: i19-i22. doi:10.1107/S1600536805041851.
- ^ Menke J.B. (1925). "Nitration with nitrates". Recueil des Travaux Chimiques des Pays-Bas. 44: 141. doi:10.1002/recl.19250440209.
- ^ Balogh, M. "Copper(II) Nitrate–K10 Bentonite Clay" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI:10.1002/047084289X.
- ^ Collet, Christine (1990). "Clays Direct Aromatic Nitration". Angewandte Chemie International Edition in English. 29 (5): 535-536. doi:10.1002/anie.199005351.
- ^ "Likasite". www.mindat.org. 15 Mayıs 2022 tarihinde kaynağından arşivlendi.
- ^ a b "Buttgenbachite". www.mindat.org. 15 Mayıs 2022 tarihinde kaynağından arşivlendi.
- ^ "Gerhardtite". www.mindat.org. 4 Aralık 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Aralık 2022.
- ^ "Rouaite". www.mindat.org. 4 Aralık 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Aralık 2022.
- ^ a b International Mineralogical Association (21 Mart 2011). "List of Minerals". www.ima-mineralogy.org. 15 Mart 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Aralık 2022.
Dış bağlantılar
| HNO3 | He | ||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO3)-4 | RONO2 | NO-3 NH4NO3 | HOONO2 | FNO3 | Ne | ||||||||||
| NaNO3 | Mg(NO3)2 | Al(NO3)3 | Si | P | S | ClONO2 | Ar | ||||||||||
| KNO3 | Ca(NO3)2 | Sc(NO3)3 | Ti(NO3)4 | VO(NO3)3 | Cr(NO3)3 | Mn(NO3)2 | Fe(NO3)2 Fe(NO3)3 | Co(NO3)2 Co(NO3)3 | Ni(NO3)2 | CuNO3 Cu(NO3)2 | Zn(NO3)2 | Ga(NO3)3 | Ge | As | Se | BrNO3 | Kr |
| RbNO3 | Sr(NO3)2 | Y(NO3)3 | Zr(NO3)4 | Nb | Mo | Tc | Ru(NO3)3 | Rh(NO3)3 | Pd(NO3)2 Pd(NO3)4 | AgNO3 Ag(NO3)2 | Cd(NO3)2 | In(NO3)3 | Sn(NO3)4 | Sb(NO3)3 | Te | INO3 | Xe(NO3)2 |
| CsNO3 | Ba(NO3)2 | Hf(NO3)4 | Ta | W | Re | Os | Ir | Pt(NO3)2 Pt(NO3)4 | Au(NO3)3 | Hg2(NO3)2 Hg(NO3)2 | TlNO3 Tl(NO3)3 | Pb(NO3)2 | Bi(NO3)3 BiO(NO3) | Po(NO3)4 | At | Rn | |
| FrNO3 | Ra(NO3)2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| La(NO3)3 | Ce(NO3)3 Ce(NO3)4 | Pr(NO3)3 | Nd(NO3)3 | Pm(NO3)3 | Sm(NO3)3 | Eu(NO3)3 | Gd(NO3)3 | Tb(NO3)3 | Dy(NO3)3 | Ho(NO3)3 | Er(NO3)3 | Tm(NO3)3 | Yb(NO3)3 | Lu(NO3)3 | |||
| Ac(NO3)3 | Th(NO3)4 | PaO2(NO3)3 | UO2(NO3)2 | Np(NO3)4 | Pu(NO3)4 | Am(NO3)3 | Cm(NO3)3 | Bk(NO3)3 | Cf | Es | Fm | Md | No | Lr | |||
![alfa polimorf[1]](https://upload.wikimedia.org/wikipedia/commons/thumb/c/c3/Anhydrous-copper%28II%29-nitrate-unit-cell-3D-bs-17.png/110px-Anhydrous-copper%28II%29-nitrate-unit-cell-3D-bs-17.png)
![beta polimorf[2]](https://upload.wikimedia.org/wikipedia/commons/thumb/2/2f/Beta-copper%28II%29-nitrate-unit-cell-3D-bs-17.png/110px-Beta-copper%28II%29-nitrate-unit-cell-3D-bs-17.png)