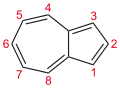
Azulen
 | |
 | |
| Adlandırmalar | |
|---|---|
Azulene | |
Sistematik IUPAC adı Bisiklo[5.3.0]dekapentaen | |
| Tanımlayıcılar | |
CAS numarası | |
3D model (JSmol) | |
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.005.449 |
| KEGG | |
PubChem CID | |
CompTox Bilgi Panosu (EPA) | |
| |
| |
| Özellikler | |
| Erime noktası | 99 - 100 |
| Kaynama noktası | 242 |
| Çözünürlük (su içinde) | 0.02 |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |
Azulen organik bir bileşiktir ve Naftalinin bir izomeridir. Naftalinin renksiz olmasına karşın, azulen koyu mavi bir renge sahiptir. İki terpenoid, vetivazulen (4,6-dimetil-2-izopropilazulen) ve guaiazulen (1,4-dimetil-7-izopropilazulen), bu özelliklere sahip azulen iskeletli maddeler, doğal olarak mantar pigmentlerinde, Peygamber ağacı (guaiac wood) yağında ve bazı deniz omugasızlarında bulunabilir.
Azulenin 15. yüzyılda Alman papatyasının buhar damıtımıyla azur-mavisi renkveren (kromofor) elde edilmesine dayanan uzun bir tarihi vardır. Renkveren ilk olarak civanperçemi ve acı pelinde keşfedildi ve 1863'te Septimus Piesse tarafından adlandırıldı. Yapısı ilk olarak Lavoslav Ružička tarafından keşfedildi, ardından 1937'de Placidus Plattner tarafından organik sentezi yapıldı.
Yapısı ve bağlanması

Azulenin genellikle siklopentadien ve sikloheptatrien halkalarının füzyonundan kaynaklandığı görülür. Naftalin ve siklodekapentaen gibi 10 pi elektron sistemindedir. Aromatik özellikleri sergiler: (i) periferik bağlarının benzer uzunlukları vardır ve (ii) Friedel-Crafts benzeri yerdeğiştirmelere uğrarlar. Aromatikliğinden gelen istikrar, naftalinin yarısı kadardır.
Naftalinin aksine dipol momenti (iki kutup kolcuğu) 1.08 D'dir,[2] naftalinin ise sıfırdır. Bu polarite (kutuplaşma) azulenin 6 π-elektron siklopentadienil anyonu ve 6 π-elektron tropilyum katyonu füzyonu olmasıyla açıklanabilir: yedi üyeli halkadan bir elektron, beş üyeli halkaya transfer edilir ve Hückel kuralına göre aromatik kararlılık sağlanır. Reaktivite çalışmaları yedi üyeli halkanın elektrofilik ve beş üyeli halkanın nükleofilik olduğunu doğrular.
Temel halin dipolar doğası koyu renkte yansıtılır, bu durum doymamış küçük aromatik bileşenler için nadirdir. Azulenin bir diğer önemli özelliği de üst uyarılmış halinde floresan sergileyerek Kasha kuralına uymamasıdır (S2 → S0).[3]
Organik sentezi
Azulenin sentetik yollarla sentezi, alışılmadık yapısı nedeniyle uzun süre ilgi çekici olmuştur. 1939'da ilk olarak St. Pfau ve Plattner tarafından indane ve etil diazoasetat ile başlanılan bir metot bildirilmiştir.[4]
Verimli bir bir-pot yolu da siklopentadienin doymamış C5-sintonlar ile halkalaşmasıdır.[5] Aşağıda gösterilen diğer bir yaklaşım da siklopentatrienden sentezlenmesidir, bu alternatif yöntem uzun süredir bilinmektedir.[6]

Organometalik kompleksleri
Organometalik kimyada azulen, düşük değerlikli metal merkezleri için ligand görevi görür, aksi takdirde hem siklopentadienil hem de sikloheptatrienil ligandlarıyla π-kompleksleri kurarlar. Örnek kompleksler (azulen)Mo2(CO)6 ve (azulen)Fe2(CO)5.[7]
İlgili bileşikler
1-Hidroksiazulen kararsız yeşil bir yağdır ve keto–enol tautomerism özelliği göstermez.[8] 2-Hidroksiazulen, 2-metoksiazulen ile hidrobromik asidin hidroliziyle elde edilir. Kararlıdır ve keto–enol tautomerism göstermez.[9] 2-hidroksiazulenin sudaki pKa değeri 8.71dir. Fenol veya naftolden daha asidiktir. 6-hidroksiazulenin sudaki PKa değeri 7.38dir, o da fenol veya naftolden daha asidiktir.
Naft[a]azulende, Naftalin halkası azulenin 1,2-pozisyonunda yoğunlaşır. Böyle bir sistemde[10] düzlemsellikten kaynaklanan deformasyonun tetrahelisene benzer olduğu bulunmuştur.
Kaynakça
- ^ Harmon AD, Weisgraber KH, Weiss U (1980). "Preformed azulene pigments of Lactarius indigo (Schw.) Fries (Russulaceae, Basidiomycetes)". Cellular and Molecular Life Sciences (Experientia). 36 (1). ss. 54-56. doi:10.1007/BF02003967. ISSN 1420-682X.
- ^ Anderson, Arthur G.; Steckler, Bernard M. (Eylül 1959). "Azulene. VIII. A Study of the Visible Absorption Spectra and Dipole Moments of Some 1- and 1,3-Substituted Azulenes 1,2". Journal of the American Chemical Society (İngilizce). 81 (18): 4941-4946. doi:10.1021/ja01527a046. ISSN 0002-7863. 12 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 12 Nisan 2023.
- ^ Tétreault, N.; Muthyala, R.S.; Liu, R.S.H.; Steer, R.P. (1999). "Control of the Photophysical Properties of Polyatomic Molecules by Substitution and Solvation: The Second Excited Singlet State of Azulene". J. Phys. Chem. A. 103 (15). ss. 2524-31. doi:10.1021/jp984407q.
- ^ Zur Kenntnis der flüchtigen Pflanzenstoffe VIII. Synthese des Vetivazulens Alexander St. Pfau, Pl. A. Plattner Helvetica Chimica Acta Volume 22 Issue 1, Pages 202–08 1939 DOI:10.1002/hlca.19390220126
- ^ Klaus Hafner; Klaus-Peter Meinhardt. "Azulene". Organic Syntheses.; Collective Volume, 7, s. 15
- ^ Approach to the Blues: A Highly Flexible Route to the Azulenes Sébastien Carret, Aurélien Blanc, Yoann Coquerel, Mikaël Berthod, Andrew E. Greene, Jean-Pierre Deprés Angewandte Chemie International Edition Volume 44, Issue 32, Pages 5130–33 2005 Abstract 16 Aralık 2012 tarihinde Archive.is sitesinde arşivlendi
- ^ Melvyn R. Churchill "Transition Metal Complexes of Azulene and Related Ligands" Progress in Inorganic Chemistry 1970, volume 11. DOI:10.1002/9780470166123.ch2
- ^ Asao, Toyonobu; Shunji Ito; Noboru Morita (1989), "1-Hydroxyazulene and 3-hydroxyguaiazulene: Synthesis and their properties", Tetrahedron Letters, 30 (48), ss. 6693-6696, doi:10.1016/S0040-4039(00)70653-8
- ^ Takase, Kahei; Toyonobu Asao; Yoshikazu Takagi; Tetsuo Nozoe (1968), "Syntheses and some properties of 2- and 6-hydroxyazulenes", Chemical Communications (London), 7, ss. 368b-370, doi:10.1039/C1968000368B
- ^ Yamamura, Kimiaki; Kawabata, Shizuka; Kimura, Takatomo; Eda, Kazuo; Hashimoto, Masao (2005). "Novel Synthesis of Benzalacetone Analogues of Naphth[a]azulenes by Intramolecular Tropylium Ion-Mediated Furan Ring-Opening Reaction and X-ray Investigation of a Naphth[1,2-a]azulene Derivative". The Journal of Organic Chemistry. 70 (22). s. 8902. doi:10.1021/jo051409f. PMID 16238325.
Dış bağlantılar
- MSDS web Sitesi 18 Ekim 2007 tarihinde Wayback Machine sitesinde arşivlendi.
- MSDS web Sitesi 7 Kasım 2017 tarihinde Wayback Machine sitesinde arşivlendi.