
Azot ya da nitrojen, simgesi N olan bir element olup atom numarası 7'dir. Renksiz, kokusuz, tatsız ve inert bir gazdır. Azot, dünya atmosferinin yaklaşık %78'ini oluşturur ve tüm canlı dokularında bulunur. Azot ayrıca, amino asit, amonyak, nitrik asit ve siyanür gibi önemli bileşikler de oluşturur.

Kimya'da, hidrojen bağı öncelikle daha elektronegatif bir "verici" atom veya gruba (Dn) kovalent bağla bağlanan bir hidrojen (H) atomu ile ve yalnız bir çift elektron taşıyan başka bir elektronegatif atom arasındaki elektrostatik çekim kuvvetidir.
Hidrazin (N2H4), amonyaktaki bir hidrojen yerine NH2 (amino) grubunun geçmesi sonucunda oluşur. Hidrazindeki her bir N atomunun yükseltgenme basamağı (değerlik) -2'dir. Hidrazin bifonksiyonel bir bazdır. Susuz N2H4, dumanlar oluşturan renksiz ve yanıcı bir sıvıdır. Saf hidrazin, örneğin hidrazin hidrat gibi sulu çözelti içinde işlenmedikçe oldukça toksiktir.

Van Arkel-de Boer işlemi, Anton Eduard van Arkel ve Jan Hendrik de Boer tarafından 1925 yılında geliştirilmiş metal üretim yöntemidir.

Kimyasal buğu taşınımı, uçucu olmayan katıları billurlaştırmak ya da saflaştırmak için kullanılan yöntem. Schäfer tarafından yaygınlaştırılan bu tekniğin temel prensibi, taşınım sırasında uçucu olmayan bileşiklerin uçucu türevlerine tersinir dönüşümüdür. Bu özelliği ile benzer bir metot ancak biriktirme için bileşiğin uçucu öncüllerinin kullanıldığı kimyasal buhar biriktirmeden ayrılır. Ancak, iyodürün etkin madde olarak kullanıldığı Van Arkel-de Boer işlemi ile benzerlik taşır. Titanyum ve vanadyumun saflaştırılması için kullanılan bu yöntemden esinlenilmiş olması muhtemeldir.

Carl Bosch Nobel Ödülü bulunan Alman kimyager ve mühendis. Endüstriyel kimya alanının öncülerindendir. Dünyanın en büyük kimya şirketi olan IG Farben'nin kurucusudur.

Cıva(II) fülminat, Hg(CNO)2, primer patlayıcıdır. Sürtünme ve şoka çok duyarlı olduğundan dolayı özellikle diğer patlayıcıları patlatmak için kullanılan darbeli kapsüller ve patlatma kapsüllerinde bir tetikleyici olarak kullanılır.
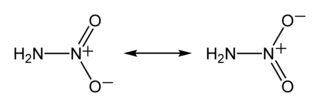
Nitramid, H2NNO2, bir kimyasal bileşiktir. Nitramidin organik türevleri, RNHNO2 nitroaminler olarak adlandırılır ve RDX ve HMX gibi örnekleri güçlü bir patlayıcı olarak kullanılırlar.

Amonyum klorür ya da daha çok bilinen adıyla Nişadır, formülü NH4Cl olan bir kimyasal bileşiktir. Suda yüksek oranda çözünen, beyaz kristallere sahip bir tuzdur. Amonyum klorür çözeltileri hafif asidiktir. Doğada mineral halde bazı volkan bacalarının etrafında bulunan haline sal amonyak denir. Bazı tür meyan ballarında bir aroma maddesi olarak kullanılır. Nişadır, hidroklorik asit ve amonyak arasında gerçekleşen reaksiyonla sonucu oluşur.
İyot pentafluorür, IF5 kimyasal formülüne sahip florür ve iyottan oluşan bir interhalojen bileşiktir. 3.250 g cm−3 yoğunluğa sahip, renksiz veya sarı bir sıvıdır. İlk olarak 1891'de Henri Moissan tarafından flor gazı içinde katı iyot yakılarak sentezlendi. Bu ekzotermik reaksiyon, reaksiyon koşulları iyileştirilmiş olmasına rağmen hala iyot pentaflorür üretmek için kullanılır. I2 + 5 F2 → 2 IF5

İyot heptaflorür, diğer adıyla iyot(VII) florür ya da iyot florür, IF7 kimyasal formülüne sahip interhalojen bileşiktir. VSEPR teorisinde öngörüldüğü gibi alışılmadık bir beşgen bipiramidal yapıya sahiptir. Molekül, Berry mekanizmasına benzeyen ancak heptakoordineli bir sistem için kullanılan sahte bir Bartell mekanizması isimli bir yeniden düzenlemeye tabi tutulabilir. 4.5 °C'de eriyen renksiz kristallerden oluşur: sıvı aralığı son derece dardır, kaynama noktası 4.77 °C'dedir. Yoğun buhar, küflü ve buruk bir kokuya sahiptir. Molekül D5h simetriye sahiptir.
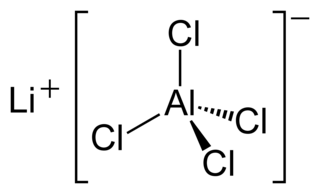
Lityum tetrakloroalüminat (LAC, lityum alüminyum klorür), LiAlCl4 formülüne sahip inorganik bir bileşiktir.

Kloroplatinik asit (hekzakloroplatinik asit olarak da bilinir), [H3O]2[PtCl6](H2O)x (0≤x≤6) formülüne sahip bir inorganik bileşiktir. Kırmızı bir katı, genellikle sulu bir çözelti olarak önemli bir platin kaynağıdır. Genellikle kısaca H2PtCl6 olarak yazılsa da, hekzakloroplatinat anyonunun (PtCl62-) hidronyum (H3O+) tuzudur. Hekzakloroplatinik asit oldukça higroskopiktir.
Disülfür diklorür S
2Cl
2 formüllü kükürt ve Klor bileşiğidir.

Baryum klorür, BaCl2 formüllü inorganik bir bileşik'tir. Bu bileşik baryum'un suda-çözünen en yaygın tuzlarından biridir. Diğer baryum tuzlarının çoğu gibi, baryum klorür beyaz toz halinde ve zehirlidir. Alevde sarı-yeşil renk verir. Ayrıca higroskopiktir, ilk önce dihidrat BaCl2(H2O)2' ye dönüşür.

Claude Louis Berthollet 1804'te Fransız Senatosu başkan yardımcısı olan Savoy-Fransız kimyagerdir. Ters kimyasal reaksiyonların mekanizması yoluyla kimyasal denge teorisine yaptığı bilimsel katkılar ve modern kimyasal terminolojiye katkısıyla tanınır. Pratik bir temelde, Berthollet klor gazının ağartma etkisini ilk gösteren ve modern bir ağartma maddesi olarak bir sodyum hipoklorit çözeltisi geliştiren ilk kişidir.

Klor triflorür, formülü ClF3 olan interhalojen bir bileşiktir. Zehirli, aşındırıcı ve aşırı reaktiftir. Gaz hâlindeyken renksizken sıvı hâlindeyken solgun yeşilimsi sarı renktedir. Yarı iletken sanayiinde, nükleer yakıtların yeniden işlenmesinde, roket itici yakıtlarında ve diğer endüstriyel alanlarda kullanılır. Benzen, toluen, eter, alkol, asetik asit, hekzan gibi çözücüler ile reaksiyona girer. Karbon tetraklorürde çözünür ancak yüksek konsantrasyonlarda patlayıcı olabilir.
Organik kimyada nitril, −C≡N fonksiyonel grubuna sahip herhangi bir organik bileşiktir. Siyano- ön eki, endüstriyel literatürde nitril terimi ile eş anlamlıdır. Nitriller, süper yapıştırıcılarda kullanılan metil siyanoakrilat ve lateks içermeyen laboratuvar ve tıbbi eldivenlerde kullanılan nitril içeren bir polimer olan nitril kauçuk dahil olmak üzere birçok yararlı bileşikte bulunur. Asetonitril çözücü olarak kullanılır.

Johan Gustav Christoffer Thorsager Kjeldahl, kendisinden sonra Kjeldahl yöntemi olarak adlandırılan bir laboratuvar tekniği kullanarak belirli organik bileşiklerdeki nitrojen miktarını belirlemek için bir yöntem geliştiren Danimarkalı bir kimyagerdir.

Fosforil klorür, POCl
3 formülüne sahip bir sıvıdır. Nemli havada hidrolize olup fosforik asit ve hidrojen klorür dumanı açığa çıkarır. Endüstriyel olarak büyük ölçekte fosfor triklorür ve oksijen veya fosfor pentoksitten üretilir. Esas olarak fosfat esterleri yapmak için kullanılır.


















