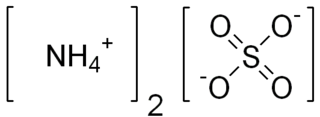Guanin (IUPAC ID: 2-amino-1H-purin-6(9H)-one) DNA ve RNA nükleik asitlerinde bulunan molekül. Diğerleri sitozin, timin, adenin ve urasil olmak üzere beş asıl azotlu bazdan biridir. C5H5N5O formullü bir pürin türevi olan guanin, Watson-Crick baz eşleşmesinde sitozin ile 3'lü hidrojen bağı kurar. Çift bağlarla eşlenmiş bir pirimidin-imidiazol çember sistemi içerir ve doymamış bi-siklik hali düzlemseldir. Guanin nükleotitine guanozin denir.

Gübre, bitkinin beslenmesinde gerekli olan kimyasal elementleri sağlamak için toprağa ilave edilen herhangi bir madde.

Azot ya da nitrojen, simgesi N olan bir element olup atom numarası 7'dir. Renksiz, kokusuz, tatsız ve inert bir gazdır. Azot, dünya atmosferinin yaklaşık %78'ini oluşturur ve tüm canlı dokularında bulunur. Azot ayrıca, amino asit, amonyak, nitrik asit ve siyanür gibi önemli bileşikler de oluşturur.

Akvaryum, çoğunlukla cam ya da yüksek dirençli plastik gibi saydam malzemelerden yapılan, genellikle balık olmak üzere, bazen de omurgasızlar ve ayrıca amfibyumlar, deniz memelileri ve sürüngenler gibi suda yaşayan bitki ve hayvanların tutulduğu ve daha çok bu canlıların sergilenmesi amacıyla kullanılan içi su dolu, küçük bir cam kavanozdan büyük su tanklarına kadar geniş bir yelpazede yer alan kap ve yapılar. Akvaryum sahibi olmak dünya çapında yaklaşık 60 milyon kişi tarafından paylaşılan popüler bir hobidir. Çağdaş akvaryumların öncülerinin ilk çıktığı 1850'li yıllardan beri, özellikle akvaryum balıklarını sağlıklı tutabilmek için daha karmaşık ışıklandırma ve filtreleme sistemleri de geliştirildikçe akvaryum ile ilgilenenlerin sayısı artmıştır. Halka açık akvaryum'lar, evdeki akvaryumların büyük ölçekteki kopyalarıdır. Osaka Akvaryum, 5.400 m3'lük su tankı ve 580 türden oluşan su canlısı koleksiyonuna sahiptir ve Birleşik Krallık'ta yapılması planlanan National institute for research into aquatic habitats 40 hektarlık büyüklüğüyle dünyanın en büyük akvaryumu olacaktır.

Mazer ya da maser, atomların, dışarıdan uyarılması neticesinde dışarıya salınan radyasyon yardımı ile elde edilen, genliği yükseltilmiş elektromanyetik dalga. Mazer, önceleri ilk mazerin mikrodalga frekansında çalışması sebebiyle İngilizce cümlesindeki kelimelerin baş harflerinin alınmasından türetilmiştir. Bugünse işitme frekansından itibaren, görünen ve morötesi frekanslı elektromanyetik bölgelerde dahi aynı prensip tatbik edildiğinden mazer, Molecular amplification by Stimulated Emission of Radiation olarak tarif edilmektedir. Mazer, uyarılmış radyasyon yayılımıyla mikrodalga veya moleküler dalga kuvvetlendirilmesi demektir. Cihaz, hassas olarak tayin edilmiş frekansta mikrodalga osilasyonları (titreşimleri) ve düşük gürültü seviyeli amplifikasyon (kuvvetlendirme) elde etmeyi sağlar. Bu maksatla atomların ve moleküllerin iç enerjisinden faydalanan bir amplifikatör ve osilatör grubu kullanılır. Aletin çalışmasının temel prensibi olan uyarılmış emisyon, uyarılmış haldeki bir atoma, dışarıdan eşit enerjili bir fotonun çarpması sonucu atomun aynı özellikli bir foton yayması şeklinde meydana gelir. Böylece atoma çarpan foton veya dalgalar çarptıkları uyarılmış atomlar tarafından yayılan fotonlarla kuvvetlenir. Bir mazer, gaz veya katı halde aktif bir ortamdan ibarettir. Sistem çeşitli frekanslar halinde elektromanyetik bir radyasyona maruz bırakılır. İçerideki atomların çoğu bu tesirle yüksek enerjili (uyarılmış) hale gelir. Böylece uyarılmış bir frekans meydana gelir. Aktif ortam, rezonans sağlayan bir boşlukla çevrili olduğundan, tek bir çıkış frekansına eşdeğer osilasyon modlu paralel dalgalar meydana gelir. Çok fazla çeşitli, koherent ve tek renk ışık elde etmek amacıyla oluşturulan optik düzenekler mazerdir. Bunların optik frekanslarda çalışanlarına optik mazer veya lazer adı verilir. Birkaç milimetreden daha uzun dalga boyları için rezonatör olarak metal bir kutu kullanılır.Bu kutunun boyutu titreşim modlarından yalnızca biri atomların yaymış oldukları ışınımların frekanslarıyla çalışacak biçimde belirlenir, kutuda yalnızca bir ses frekansında rezonansa uğramış gibi belirli bir mikro dalga frekansında rezonansa gelir.
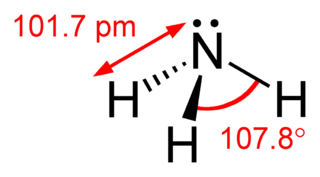
Amonyak, formülü NH3 olan; azot atomu ve hidrojen atomundan oluşan renksiz, keskin ve rahatsız edici kokulu bir bileşiktir. OH- iyonu içermediği hâlde suda zayıf baz özelliği gösterir. Bir amonyak molekülü, bir azot ve üç hidrojen atomundan oluşur. Oda sıcaklığında gaz hâlde bulunan bileşiğin ticari formu sulu çözeltiyi içermektedir.

Aminler, amonyaktaki bir veya daha fazla hidrojen atomunun organik radikaller ile değiştirilmesi yöntemiyle türetilmiş organik bileşikler ve fonksiyonel gruplardır. Yapısal olarak aminler amonyağa benzerler, ama bir veya daha fazla hidrojen atomu, alkil veya aril gibi organik sübstitüentlerle yer değiştirmiştir. Bu kuralın önemli bir istisnası RC(O)NR2 tipi bileşiklerdir (C(O) karbonil grubuna karşılık gelir), bunlara amin yerine amid denir. Amidler ve aminlerin yapıları ve özellikleri farklı olduğu için bu ayrım kimyasal olarak önemlidir. Adlandırma açısında biraz akıl karıştırıcı olan bir nokta, bir aminin N-H grubunun N-M (M= metal) ile değişmesi hâlinde buna da amid denmesidir. Örneğin (CH3)2NLi, lityum dimetilamid'dir.
Bir ideal gaz karışımında hacmi olan her gazın kendine ait bir kısmi basıncı vardır.

Yaşamın başlangıcından beri, atmosfer ve okyanuslar azot içerir. Azot canlılar için önemli bir maddedir. Canlılar yaşamlarını sürdürebilmek için oksijen ve karbondioksite ihtiyaç duydukları gibi, büyüyebilmek için de azota (N2) ihtiyaç duyarlar. Çünkü proteinlerin ve DNA'nın önemli bir bileşenidir. Azot, canlı vücudunda özellikle nükleik asitlerin, proteinlerin ve vitaminlerin yapısında %15 oranında bulunmaktadır. Gaz halindeki azot (N2), atmosferin %78'ini oluşturur. Üçlü kovalent bağı, bu iki azot atomunu sıkıca bir arada tutar. Azot Döngüsü, daha çok biyosferin ince bir tabakasında gerçekleşir. Azot bileşikleri bu ince kabuk içinde birbirine dönüşür. Bu işlemlere azot döngüsü denir. Azot döngüsü yaşamın sürekliliğini sağlayan bir doğa olayıdır. Bu döngüde azot bileşikleri sürekli olarak topraktan canlılara ve sonra tekrar toprağa geri dönerler. Ancak bir miktar azot atmosfere gider ve tekrar geri alınır. Canlılar havadaki bu azotu, ihtiyaçları olmasına rağmen doğada bulunduğu gibi bünyelerine alamazlar. Bu gazın bir şekilde canlıların kullanabileceği hale dönüştürülmesi ve canlılar tarafından tüketilip bitirilmemesi için bir döngü şeklinde atmosfere geri dönmesi gerekmektedir. Bu zorunluluğu ise mikroskobik bakteriler ve baklagiller karşılamaktadır.
Hidrazin (N2H4), amonyaktaki bir hidrojen yerine NH2 (amino) grubunun geçmesi sonucunda oluşur. Hidrazindeki her bir N atomunun yükseltgenme basamağı (değerlik) -2'dir. Hidrazin bifonksiyonel bir bazdır. Susuz N2H4, dumanlar oluşturan renksiz ve yanıcı bir sıvıdır. Saf hidrazin, örneğin hidrazin hidrat gibi sulu çözelti içinde işlenmedikçe oldukça toksiktir.

Dizel egzoz sıvısı dizel motorun yarattığı hava kirliliği miktarını azaltmak için kullanılan bir sıvıdır. DEF, %32,5 üre ve %67,5 deiyonize su ile yapılan sulu bir üre çözeltisidir. DEF, nitrojen konsantrasyonunu azaltan bir çözeltidir.
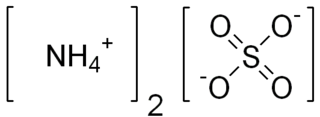
Amonyum sülfat, (NH4)2SO4 formülüne ve çok sayıda ticari kullanıma sahip bir inorganik tuzdur. Toprak gübresi olarak yaygın bir şekilde kullanılır. %21 azot ve %24 kükürt içerir.

Amonyum klorür ya da daha çok bilinen adıyla Nişadır, formülü NH4Cl olan bir kimyasal bileşiktir. Suda yüksek oranda çözünen, beyaz kristallere sahip bir tuzdur. Amonyum klorür çözeltileri hafif asidiktir. Doğada mineral halde bazı volkan bacalarının etrafında bulunan haline sal amonyak denir. Bazı tür meyan ballarında bir aroma maddesi olarak kullanılır. Nişadır, hidroklorik asit ve amonyak arasında gerçekleşen reaksiyonla sonucu oluşur.

Azot triklorür, trikloramin olarak da bilinen formülü NCl3 olan kimyasal bileşik. Sarı, yağımsı, keskin kokulu bir sıvıdır. En sık amonyak türevleri ve klor arasındaki kimyasal reaksiyon sonrası oluşmaktadır, yüzme havuzlarındaki oluşumu buna bir örnektir.
Gümüş bromür (AgBr), yumuşak, soluk sarı, suda çözünmeyen bu tuz diğer gümüş halideler içinde geçerli olan ışığa duyarılık özelliği ile bilinir. Bu özellik gümüş halidlerin modern fotoğrafik malzemelerin temelini oluşturmalarına sebebiyet vermiştir. AgBr fotoğraf filmelerinde sıkça kullanılır ve bazılarınca Torino Kefeni yapımında kullanılmıştır. Bu tuz doğal olarak bromaritit minerali hâlinde bulunabilir.
İzopentan (C5H12),metilbütan ya da 2-metilbütan, beş karbon atomuna sahip bir dallanmış zincirli alkandır. İzopentan, oda sıcaklığında ve basıncında aşırı uçucu ve aşırı yanıcı bir sıvıdır. Aynı zamanda standart sıcaklık ve basınçta en az yoğun olan sıvıdır. Normal kaynama noktası oda sıcaklığından sadece birkaç derece yüksektir ve izopentan sıcak bir günde kolayca kaynamakta ve buharlaşmaktadır. İzopentan yaygın olarak sıvı azot ile birlikte -160 °C sıvı banyo sıcaklığına ulaşmak için kullanılır. Doğal gaz tipik olarak %1 veya daha az izopentan içerir.
Nitrojenazlar (EC 1.18.6.1EC 1.19.6.1) siyanobakteriler (mavi-yeşil algler) gibi bazı bakteriler tarafından üretilen enzimlerdir. Bu enzimler azot gazının (N2) amonyak (NH3) maddesine indirgenmesinden sorumludur. Nitrojenzlar, azot fiksasyon sürecinde önemli bir adım olan bu reaksiyonu katalize ettiği bilinen tek enzim ailesidir. Azot fiksasyonu tüm yaşam formları için önemlidir, çünkü azot bitkileri, hayvanları ve diğer organizmaları yaratan moleküllerin (nükleotitler, amino asitler) biyosentezi için gereklidir. Nif genleri veya homologları tarafından kodlanırlar. Protoklorofilid redüktaz ile ilgilidir.
Amonyum hidroksit, oda sıcaklığında gaz hâlde bulunan amonyağın sulu çözeltisine verilen addır. Formülü olarak NH4+.OH- gösterilir.

Haber-Bosch işlemi olarak da adlandırılan, Haber işlemi, yapay bir azot bağlanması işlemidir ve günümüzde amonyak üretimi için kullanılan ana endüstriyel yöntemdir. İşlem adını, 20, yüzyılın ilk on yılında geliştiren mucitleri Alman kimyagerler Fritz Haber ve Carl Bosch’tan almıştır. İşlem yüksek sıcaklıklar ve basınçlar altında bir metal katalizör kullanarak hidrojen (H2) ile atmosferik azot (N2)’u reaksiyonla amonyağa (NH3) dönüştürür:

Ostwald işlemi nitrik asit (HNO3) yapmak için kullanılan bir kimyasal işlemdir. Wilhelm Ostwald işlemi geliştirdi ve 1902'de patentini aldı. Ostwald işlemi modern kimya endüstrisinin dayanak noktasıdır ve gübre üretiminde yaygın olarak kullanılan ana hammaddeyi sağlar. Tarihsel ve pratik olarak, Ostwald işlemi elzem bir hammadde olan amonyak (NH3) hammaddesini sağlayan Haber işlemi ile yakından ilişkilidir.